Название: Ионометрическое определение хлоридов в растворах хроматов
Вид работы: доклад
Рубрика: Биология и химия
Размер файла: 21.54 Kb
Скачать файл: referat.me-20918.docx
Краткое описание работы: Задача определения хлоридов в хроматных растворах пришла от гальваников. Дело в том, что в травильных ваннах необходимо было контролировать содержание хлоридов.
Ионометрическое определение хлоридов в растворах хроматов
Немировский А.М.
Задача определения хлоридов в хроматных растворах пришла от гальваников. Дело в том, что в травильных ваннах необходимо было контролировать содержание хлоридов. Зачем это нужно я не знаю до сих пор, но задачу контроля хлоридов я решил.
Состав раствора ванны был совершенно убийственен: 400 г/л CrO3 . В этом растворе следовало определять хлорид с концентрацией более 10-3 M.
Делая ставку на хлоридселективный электрод ЭМ-Сl-01, я начал экспериментальную работу. Сначала я разбавил анализируемый раствор в 10 раз для того, чтобы снизить агрессивность среды. В итоге pH среды примерно стал равен 1 при содержании CrO3 = 40 г/л. Затем предо мной встал вопрос о нейтрализации кислотной среды пробы. Дальнейшие исследования показали, что нейтрализация ухудшает условия определения хлорида, делая дальнейший анализ невозможным. Почему?
Дело в том, что в кислой среде CrO3 преимущественно существует в виде Cr2 O7 2- . По мере увеличения pH, преимущество получает форма CrO4 2- . С другой стороны селективность хлоридного электрода к тому или иному аниону определяется растворимостью соединения этого аниона с катионом серебра. (Хлоридселективный электрод представляет собой пресованную таблетку, состоящую из смеси хлорида и сульфида серебра.) Поскольку растворимость Ag2 CrO4 очевидно меньше растворимости Ag2 Cr2 O7 , то это означает, что хлоридселективный электрод будет обладать большей чувствительностью к ионам CrO4 2- . Таким образом, напрашивается вывод о том, что стремиться к нейтрализации раствора пробы не нужно.
Калибровка электрода в растворах CrO3 дала следующие результаты.
Во-первых, перед анализом в начале рабочего дня электрод нужно было подготовить к работе, опустив его на час в раствор CrO3 . Если этого не делать, потенциал электрода испытывает существенный дрейф.
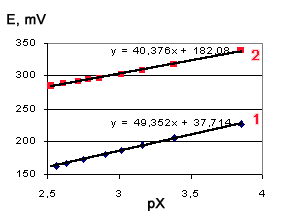
Во-вторых, калибровка по хлориду линейна по крайней мере в области концентраций pX=4-2,5, хотя наклон несколько отличается от теоретического (см. рисунок).
|
В-третьих, оказалось, что пользоваться для анализа методом градуировочного графика нельзя, так как небольшие изменения в составе пробы вызывают существенное изменение потенциала (см. рисунок). Пользоваться можно только методом добавок, поскольку наклон калибровок меняется не столь существенно. Расчеты показывают, что уменьшение концентрации CrO3 от 40 г/л до 20 г/л вызывает ошибку в 20 % при анализе методом добавок.
В заключении следует сказать о том, что измерения в такой агрессивной среде, какую создают хроматы, существенно сокращают срок службы электрода. В связи с этим хранить электрод рекомендуется в сухом состоянии, а не оставлять в анализируемом растворе.
Похожие работы
-
Соединения Сера–Кислород
Было показано, что 1, 2-циклические сульфиты реагируют с ацетатом натрия либо по механизму SN2 с атакой углерода с получением γ - лактонов, либо атакой группы S=O, с получением ацеталей.
-
К вопросу промышленного использования сточных вод в охладительных системах оборотного водоснабжения
Несмотря на то, что идея использования фенольной сточной воды в системах оборотного водоснабжения высказана давно, в промышленности она не была реализована.
-
Калий
Калий в природе. Физические и химические свойства калия.
-
Предельные эквивалентные электропроводности ионов в водных растворах
Электропроводность ионов различных элементов в водных растворах.
-
Химико-аналитические свойства ионов s-элементов
Ионы s-элементов IA группы. Ионы s-элemeнтов IIA группы.
-
Ионометрия. Метод градуировочного графика
Метод градуировочного графика состоит в измерении потенциала ИСЭ относительно вспомогательного электрода в анализируемом растворе, с последующим нахождением определяемого компонента по градуировочному графику.
-
Система нитрат европия - алюминат натрия - вода при 20 С
Согласно литературным источникам, алюминаты редкоземельных элементов получают спеканием оксидов металлов, прокаливанием смеси термически нестойких солей, взаимодействием расплавленных хлоридных смесей в токе газообразного кислорода.
-
Соляная кислота
Физические свойства. Способы получения.
-
Аналитическая классификация катионов
В основу классификации ионов в аналитической химии положено различие в растворимости образуемых ими солей и гидроксидов, позволяющее отделять (или отличать) одни группы ионов от других.
-
Ионометрическое титрование
Титрование в окрестности точки эквивалентности должно проводиться малыми порциями титранта, чтобы не пропустить максимальный скачок потенциала.