Название: Теория окислительно-восстановительных реакций
Вид работы: реферат
Рубрика: Биология и химия
Размер файла: 15.9 Kb
Скачать файл: referat.me-21647.docx
Краткое описание работы: После открытия кислорода, французскому химику Лавуазье удалось выяснить, что горение есть реакция соединения с кислородом. В соответствии латинским наименованием кислорода "oxigenium" реакции соединения с кислородом были названы окислением.
Теория окислительно-восстановительных реакций
После открытия кислорода, французскому химику Лавуазье удалось выяснить, что горение есть реакция соединения с кислородом. В соответствии латинским наименованием кислорода "oxigenium" реакции соединения с кислородом были названы окислением.
2Mg0 +O20=2Mg+2O-2
Обратный процесс полного или частичного отнятия кислорода от веществ называется восстановлением. При восстановлении оксида элемент, соединённый с кислородом, меняет своё состояние - образует простое вещество, т.е. восстанавливается.
Fe2+3O3-2+2Al0=Al2+3O3-2+2Fe0
Вы заметили, что в этих реакциях изменились степени окисления химических элементов. Химические реакции, в результате которых происходит изменение степеней окисления атомов химических элементов или ионов, образующих реагирующие вешества, называют окислительно-восстановительными реакциями.
В соответствиии с теорией электронного строения атома окисление и восстановление легко объясняется как процесс отдачи или присоединения электронов. В окислительно-восстановительных реакциях электроны не уходят из сферы реакции, а переносятся от одного элемента к другому.
Рассмотрим реакцию взаимодействия магния с кислородом.
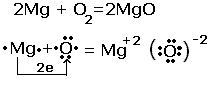
Из схемы видно, что атом магния отдал 2 электрона атому кислорода, за счёт такого перехода химические элементы изменили степени окисления. Протекают два процесса. Процесс отдачи электронов и процесс их присоединения , которые называются соответственно окислением и восстановлением.
Вещества, участвующие в окислительно-восстановительных реакциях, и у которых изменились степени окисления, являются либо окислителямия,либо восстановителями.
Окислитель - это атомы, ионы или молекулы, которые принимают электроны.
Восстановитель - это атомы, ионы или молекулы, которые отдают электроны.
Из уравнения реакции видно, что магний является восстановителем, а кислород - окислителем.
| Запомните! Восстановитель в химической реакции всегда окисляется, окислитель - восстанавливается. |
Важнейшие восстановители и окислители.
| Восстановители | Окислители |
| Металлы, водород, уголь | Фтор, хлор, бром, иод |
| Оксид углерода (II) CO | Перманганат калия KMnO4, манганат калия K2MnO4, оксид марганца (IV)MnO2 |
| Сероводород H2Sоксид серы (IV)SO2 | Бихромат калия K2Cr2O7, хромат калия K2CrO4 |
| HI, HBr, HCl | Азотная кислота HNO3 |
| Хлорид олова (II) SnCl2 | Кислород O2, озон O3, перекись водорода H2O2 |
| Азотистая кислота HNO2 | Серная кислота (конц.) H2SO4 |
| Фосфористая кислота H3PO3 | Оксид меди (II) CuO, оксид серебра Ag2O |
| Хлорид железа (III) FeCl3 | |
| Царская водка (смесь концентрированных соляной и азотной кислот) |
Похожие работы
-
Cульфоксидный комплекс гидрохинона как фотоинициатор полимеризации метилметакрилата
Рассматривается поведение сульфоксидного комплекса гидрохинона в радикальной полимеризации метилметакрилата. Показано, что в отличии от гидрохинона такой комплекс участвует в фотоинициировании полимеризации.
-
Разновидности химических процессов
Исследование брожения. Цепные реакции. Химия экстремальных состояний. Самораспространяющийся высокотемпературный синтез.
-
Фтор
Атом, молекула, ядерные свойства. Строение атома фтора.
-
Фтор
Физические свойства. Химические свойства. Формы нахождения в природе.
-
Экзамен по химии за 9 класс
Экзаменационные вопросы по химии.
-
Классификация химических реакций
Классификация по числу и составу исходных веществ и продуктов реакции. Агрегатное состояние реагентов и продуктов реакции. Возможность протекания реакции в прямом и обратном направлении.
-
Закон Авогадро
В равных объемах различных газов при постоянных температуре и давлении содержится одинаковое число молекул.
-
Основные классы неорганических соединений и типы химических реакций
Основные классы неорганических соединений; кислоты, основание и соли. Номенклатура неорганических соединений. Основные типы химических реакций. Реакции окисления и восстановления. Степень окисления и валентность.
-
Азот
Около двухсот лет назад ученые открыли, что в атмосфере содержится газ, непригодный для дыхания и не поддерживающий горение. Атмосфера почти на 4/5 состоит из этого газа.
-
Экзамен по химии (11 класс)
Билеты по химии за 11 класс.