Название: Анализ почвы
Вид работы: контрольная работа
Рубрика: Химия
Размер файла: 93.86 Kb
Скачать файл: referat.me-368189.docx
Краткое описание работы: Мониторинг, классификация почв. Методика определения гигроскопической влаги почвы, обменной кислотности. Определение общей щелочности и щелочности, обусловленной карбонат-ионами. Комплексонометрическое определение валового содержания железа в почвах.
Анализ почвы
ФЕДЕРАЛЬНОЕ АГЕНСТВО ПО ОБРАЗОВАНИЮ
ГОСУДАРСТВЕННОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ
ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ
«ЛИПЕЦКИЙ ГОСУДАРСТВЕННЫЙ ТЕХНИЧЕСКИЙЦ УНИВЕРСИТЕТ»
Кафедра химии
Зачетная задача по предмету:
«Аналитические методы анализа в мониторинге объектов окружающей среды»
на тему:«Анализ почвы»
Выполнил:
студент ХМФ гр. АХ-06-1
Ирхина Э.Е.
Проверил:
Дергунова Елена Сергеевна
Липецк 2010 г.
Введение
Почва – особое природное образование, сформировавшееся в результате длительного преобразования поверхностных слоев литосферы под совместным взаимообусловленным взаимодействием гидросферы, атмосферы, живых и мертвых организмов. Почва состоит из органических, минеральных, органоминеральных комплексных соединений, почвенной влаги, воздуха и живых существ, населяющих ее.
Почва является одним из элементов биосферы, которые обеспечивают циркуляцию химических веществ в системе окружающая среда — человек. Причем это относится не только к эндогенным химическим веществам, но и к экзогенным химическим веществам, поступающим в почву с выбросами промышленных предприятий, сточными водами, выбросами авто- и авиатранспорта, при обработке сельскохозяйственных земель
Почва является местом сбора и хранения большого числа загрязнителей, куда они попадают в результате техногенной деятельности человека и выбросов загрязнителей из природных источников. Она не обладает свойством подвижности, характерным для других природных сред, и наиболее подвержена загрязнению. Кроме того, многие соединения, попадая в почву, вследствие химических и микробиологических превращений могут стать более токсичными, чем исходные. Из почвы может происходить загрязнение воды, воздуха, пищевых продуктов и других элементов биосферы канцерогенными и радиоактивными веществами.
Вследствие этого необходимо регулярно проводить мониторинг почв в различных раонах города и области.
В данной зачетной задаче проводился общий анализ почвы, отобранной в Усманском районе, Липецкой области.
1 Мониторинг почв
Мониторинг состояния почв предназначен для регулярных наблюдений за химическим загрязнением почв, их состоянием; обеспечивает сбор, передачу и обработку полученной информации в целях своевременного выявления негативных процессов, прогнозирования их развития, предотвращения вредных последствий и определения степени эффективности осуществляемых природоохранных мероприятий.
В отличие от воды и атмосферного воздуха, которые являются лишь миграционными средами, почва является наиболее объективным и стабильным индикатором техногенного загрязнения. Она четко отражает эмиссию загрязняющих веществ и их фактического распределения в компонентах городской территории. Наиболее крупные промышленные города образуя обширные зоны загрязнений, постепенно превращаются в сплошные техногенные территории, представляющие серьезную опасность для здоровья проживающего на них населения.
В этой связи, постоянное наблюдение за содержанием промышленных токсикантов в почвах и тенденцией их содержанием является наиболее актуальным.
Одним из наиболее мощным факторов, приводящим к загрязнению окружающей среды, является промышленность.
Зона существенного загрязнения почв химическими элементами в окрестностях промышленных предприятий занимает площадь радиусом 10 км с гораздо большей протяженность (до 30 км и более) в направлении господствующих ветров, а также в направлении стока поверхностных и грунтовых вод.
Источниками загрязнения почвы являются:
· выбросы вредных веществ в атмосферный воздух от стационарных и передвижных источников загрязнения;
· полигоны промышленных и бытовых отходов;
· несанкционированные свалки промышленных и бытовых отходов;
· средства химической защиты растений и минеральные удобрения.
На загрязнение почвы значительное влияние оказывают проливы нефтепродуктов, неорганизованные сбросы ливневых и талых вод, а также санитарное состояние городской территории.
Классификкация почв
Основной единицей классификации почв является тип почв. Понятие «тип почв». Под типом почв понимают почвы, образованные в одинаковых условиях и обладающие сходными строением и свойствами.
К одному типу почв относятся почвы:
· 1) со сходными процессами превращения и миграции веществ;
· 2) со сходным характером водно-теплового режима;
· 3) с однотипным строением почвенного профиля по генетическим горизонтам;
· 4) со сходным уровнем природного плодородия;
· 5) с экологически сходным типом растительности.
Широко известны такие типы почв, как подзолистые, черноземы, красноземы, солонцы, солончаки и др.
Каждый тип почв последовательно подразделяется на подтипы, роды, виды, разновидности и разряды.
Подтипы почв представляют собой группы почв, различающиеся между собой по проявлению основного и сопутствующего процессов почвообразования и являющиеся переходными ступенями между типами. Например, при развитии в почве наряду с подзолистым процессом дернового процесса формируется подтип дерново-подзолистой почвы. При сочетании подзолистого процесса с глеевым процессом в верхней части почвенного профиля формируется подтип глееподзолистой почвы.
Подтиповые особенности почв отражаются в особых чертах их почвенного профиля. При выделении подтипов почв учитываются процессы и признаки, обусловленные как широтнозональными, так и фациальными особенностями природных условий. Среди последних первостепенную роль играют термические условия и степень континентальности климата.
В пределах подтипов выделяются роды и виды почв. Роды почв выделяются внутри подтипа по особенностям почвообразования, связанным прежде всего со свойствами материнских пород, а также свойствами, обусловленными химизмом грунтовых вод, или со свойствами и признаками, приобретенными в прошлых фазах почвообразования (так называемые реликтовые признаки).
Роды почв выделяются в каждом типе и подтипе почв. Самые распространенные из них:
· 1) обычный род, т. е. отвечающий по своему характеру подтипу почв; при определении почв название рода «обычный» опускается;
· 2) солонцеватые (особенности почв определяются химизмом грунтовых вод);
· 3) остаточно-солонцеватые (особенности почв определяются засоленностью пород, которая постепенно снимается);
· 4) солончаковатые;
· 5) остаточно-карбонатные;
· 6) почвы на кварцево-песчаных породах;
· 7) почвы контактно-глеевые (формируются на двучленных породах, когда супесчаные или песчаные толщи подстилаются суглинистыми или глинистыми отложениями; на контакте смены наносов образуется осветленная полоса, образующаяся за счет периодического переувлажнения);
· 8) остаточно-аридные.
Виды почв выделяются в пределах рода по степени выраженности основного почвообразовательного процесса, свойственного определенному почвенному типу.
Для наименования видов используют генетические термины, указывающие на степень развития этого процесса. Так, для подзолистых почв — степень подзолистости и глубина оподзоливания; для черноземов — мощность гумусового горизонта, содержание гумуса, степень выщелоченности; для солончаков — характер распределения солей по профилю, морфология поверхностного горизонта (пухлые, отакыренные, выцветные).
Внутри видов определяются разновидности почв. Это почвы одного и того же вида, но обладающие различным механическим составом (например, песчаные, супесчаные, суглинистые, глинистые). Почвы же одного вида и одного механического состава, но развитые на материнских породах разного происхождения и разного петрографического состава, выделяются как почвенные разряды.
Дерново-подзолистые почвы - отличаются невысоким содержанием гумуса (0,5-2,5%) и небольшим гумусовым слоем (10-20 см), в связи с этим - невысоким естественным плодородием и, как правило, кислой реакцией (рН=4-5). В большинстве случаев они пере увлажнены.
Нуждаются в дренажных и других осушительных работах, увеличении гумусового горизонта, а также регулярном известковании и внесении повышенных доз органических удобрений или землевании.
Дерново-карбонатные почвы. В отличие от дерново-подзолистых почв обладают более высокой продуктивностью (гумус - 2-4%), меньшей кислотностью рН=6 и более благоприятными физико-механическими показателями. Для получения высоких урожаев нуждаются только в повышенных дозах органических и минеральных удобрений.
Серые лесные почвы. По многим показателям близки к дерново-карбонатным почвам (только несколько выше кислотность (рН—5,5-6,5). Они склонны к замыванию и переуплотнению. Нуждаются в периодическом известковании, углублении пахотного горизонта, а также в удобрении фосфором и азотом.
Торфяно-болотные почвы. Характеризуются высоким естественным плодородием и большим содержанием азота (2-4%), низким содержанием фосфора, высокой кислотностью (рН=3,5-5) и низкими физико-механическими свойствами. Нуждаются в регулировании водного режима (осушение-орошение), внесении фосфорно-калийных удобрений, регулярном известковании и внесении микроэлементов.
Черноземные почвы. Лучшие из почв по всем показателям (уровню плодородия, глубине гумусового горизонта (если не эродированы), содержанию макро- и микроэлементов и физико-механическим параметрам почвы). Оподзоленные черноземы склонны к заиливанию и переуплотнению, а карбонатные черноземы бедны железом : в доступной для растений форме (провоцируется хлороз винограда и плодовых).
2 Методика определения гигроскопической влаги почвы
Навеску почвы 2-5 г берут на аналитических весах в предварительно высушенных при температуре 100-105 0 С и взвешенных стеклянных бюксах (бюксы взвешивают с крышками). Бюксы с почвой в течение 5 ч выдерживают в сушильном шкафу при температуре 100-1050 С. С помощью щипцов с резиновыми наконечниками бюксы вынимают из сушильного шкафа, закрывают крышками, охлаждают в эксикаторе и взвешивают. Условились считать, что выдерживание почвы в течение 5 ч при температуре 100-1050 С приводит к полной потере гигроскопической влаги. Если необходимо проверить полноту удаления гигроскопической влаги, бюксы с почвой снова ставят в сушильный шкаф на 1,5-3 ч и взвешивают. Высушивание прекращают, если масса равна или больше результата предыдущего взвешивания (увеличение массы может произойти за счет окисления некоторых компонентов почв). Расчет массовой доли гигроскопической влаги (%) проводят по уравнению:
![]()
Где m – масса воздушно-сухой почвы, г; m1 – масса высушенной почвы, г.
2.1 Определение C и органических соединений по Тюрину
Приборы и реактивы:Аналитические весы, Колба коническая термостойкая на 100 мл.,воронка стеклянная диаметром 3см,бюретка на 25 мл.,пипетка медицинская,фильтровальная бумага, хромовая смесь 0,4н,соль Мора 0,2 н, ФАК 0,2%,KMnO4 .
Ход работы:
Взять мелкодисперсную навеску 0,5 г,Поместить в колбу емкостью 100 мл. Затем в колбочки пипеткой прилить по каплям 10 мл 0,4 н р-ра K2 Cr2 O7 в H2 SO4 .Осторжно взболтать и поставить на эл. плитку.Кипятят 5 минут,одновременно проводят холостое кипячение без почвы, только 10 млK2 Cr2 O7.
После кипячения колбы охлаждают. Смывают капли хромовой смеси дистиллированной водой в колбочку и, добавив 4-5 капель 0,2% р-ра ФАК, титруют 0,2 н соли Мора.Переход окраски из вишнево-фиолетовой в зеленую. Одновременно проводят холостое титрование. По объему соли Мора, пошедшего на титрование,определяют колличество хромовой смеси, не израсходованной на окисление органического вещ-ва почвы. При титровании солью Мора избытка K2 Cr2 O7 происходит реакция:
6FeO4 (NH4 ) 2 SO4 +K2 Cr2 O7 +7H2 SO4 =Cr2 (SO4 )3 +3Fe2 (SO4 )3 +6(NH4 )2 SO4 + K2 SO4 +7H2 O
Содержание углерода вычисляют по формуле:
C%=((Vхол -Vраб )*N*0.003*100)/a ,
Где Vхол -объем соли Мора(мл) пошедший на титрование 10 мл K2 Cr2 O7 .
2.2 Определение фенола в почве
Приборы и реактивы: п-нитроаналин,NaNo2 (1н), Н2 SО4 (разбавл), Na2 CO3 (2н), смесь: уксуская кислота- бутанол- вода (3:5:2)
Ход работы:
Растворяют 5г фенола в дистиллированной воде , разбавляют до 1л.Отбирают 1мл этого раствора , содержащий 5 мл фенола , вносим в делительную воронку, прибавляем 1 мл H2 SО4 , 25 мл Na2 СО3 , 2,5 мл п-нитроаналина. Затем прибавляем еще 50 мл H2 SО4 и экстрагируют краситель 50 мл хлорбензола. Бензольный экстракт фильтруют в 50 мл колбу и доводят до метки чистым хлорбензолом (0,1 мл фенола содержит).
Далее вносим на покрытое смесью стекло, следующие концентрации: 5,0; 10,0; 20,0; 70,0; и Х мкг. Помещаем пластинку в хроматографическую камеру. Пятна фенола (розово-сиреневого цвета) появляются на расстоянии 1-15 см от стартовой линии.(Rf =0.1).
Каждое пятно экстрагируют изопропанольной смесью и измеряют оптическую плотность экстрактов при λ=540нм.
По градуировочному графику находят содержание фенола.
2.3 Определение общей щелочности и щелочности, обусловленной карбонат-ионами
Навеску почвы массой 40,0 г помещают в сухую колбу или другую емкость вместимостью 250 мл. К почве с помощью мерного цилиндра приливают 100 мл. 1 М раствора KCl. Содержимое колбы взбалтывают 1 час и фильтруют через складчатый фильтр в сухую коническую колбу. Чтобы получить прозрачные фильтраты, на фильтр переносят как можно больше почвы. Первые порции фильтрата могут опалесцировать, их перефильтровывают. Вытяжка должна быть прозрачной.
В полученной 1 М KCl-вытяжке определяют концентрацию карбонат-ионов. Для этого из мерной колбы в коническую колбу для титрования вместимостью 100 мл прибавляют 25 мл аликвоты раствора и несколько капель фенолфталеина. Титруют 0,01 М раствором H2 SO4 до обесцвечивания розовой окраски раствора. Записывают объем титранта V1 , пошедший на титрование.
Далее определяют общую щелочность. Для этого из мерной колбы в коническую колбу для титрования вместимостью 100 мл прибавляют 25 мл аликвоты раствора и несколько капель метилового-оранжевого. Титруют 0,01 М раствором H2 SO4 до изменения окраски раствора из желтой в оранжевую. Записывают объем титранта V2 , пошедший на титрование.
Концентрацию карбонат-ионов и общую щелочность вычисляют по формулам:
![]() =
= ![]() ;
;
![]() ;
;
где н – нормальность кислоты; Vа – объем аликвоты, мл; V0 – объем, добавленный к навеске почвы, мл; m – навеска почвы, г.
2.4 Методика комплексонометрического определения валового содержания железа в почвах
На конических колбах вместимостью 250 мл делают отметку на уровне, соответствующем объему 50 мл. В колбу помещают 25 мл фильтрата, полученного после отделения кремниевой кислоты, добавляют 5-7 капель концентрированной азотной кислоты и нагревают до кипения, окисляя Fe(II).
Затем в колбу добавляют 10-15 капель 25%-ного раствора аммиака, помещают кусочек индикаторной бумаги Конго-рот и добавляют по каплям сначала 25%-ный раствор аммиака, а затем 10%-ный до перехода синей окраски индикаторной бумаги в бурую. Если при этом выпадет осадок, его растворяют несколькими каплями 1 н. HCl. В колбу приливают 5 мл 1 н. HCl, и объем жидкости дистиллированной водой доводят до отметки, соответствующей 50 мл. Содержимое колбы нагревают до 50-60 °С, добавляют 1-3 капли 10%-ного раствора сульфосалициловой кислоты и титруют 0,01 М раствором комплексона III до перехода лиловой окраски сульфосалицилата железа в бледно-желтую комплексоната железа. Скорость реакции невелика, поэтому последние порции титранта добавляют медленно. Если в этой же порции анализируемого раствора будет определяться алюминий, нельзя добавлять избытка титранта.
2.5 Определение кальция и магния при совместном присутствии
Константы устойчивости этилендиаминтетраацетатов кальция и магния различаются на 2 порядка. Поэтому эти ионы нельзя оттитровать раздельно, используя только различие в константах устойчивости комплексонатов. При pHопт ~ 10 в качестве металлоиндикаторов используют эриохромовый черный Т. При этих условиях определяют сумму кальция и магния. В другой аликвотной части создают pH > 12, вводя NaOH, при этом магний осаждается в виде гидроксида, его не отфильтровывают, и в растворе определяют комплексонометрический кальций в присутствии мурексида, флуорексона или кальциона, являющихся металлоиндикаторами на кальций. Магний определяют по разности.
Выполнение определения.
1. Определение суммы кальция и магния.
Отбирают пипеткой 10 мл анализируемого раствора (водной вытяжки почвы) из мерной колбы вместимостью 100 мл в коническую колбу для титрования вместимостью 100 мл, прибавляют 2-3 мл буферного раствора с pH 10, 15 мл воды, перемешивают и прибавляют на кончике шпателя 20-30 мг смеси эриохромового черного Т и хлорида натрия. Перемешивают до полного растворения индикаторной смеси и титруют раствором ЭДТА до изменения окраски раствора из винно-красной в голубую.
2. Определение кальция.
Отбирают пипеткой 10 мл анализируемого раствора (водной вытяжки почвы) в коническую колбу для титрования вместимостью 100 мл, прибавляют 2-3 мл раствора NaOH или KOH, разбавляют водой примерно до 25 мл, вводят 20-30 мг индикаторной смеси мурексида, флуорексона, или кальциона с хлоридом натрия и титруют раствором ЭДТА до изменения окраски раствора от одной капли раствора ЭДТА.
Изменение окраски в конечной точке титрования зависит от выбранного металлоиндикатора. При использовании мурексида окраска изменяется из розовой в фиолетовую; при использовании флуорексона – из желтой с зеленой флуоресценцией в бесцветную или розовую с резким уменьшением интенсивности флуоресценции; при использовании кальциона – из бледно-желтой в оранжевую. В последнем случае щелочную среду создают только 2 М раствором KOH.
3. Определение магния. Объем титранта, израсходованный на титрование магния, вычисляют по разности объемов ЭДТА, пошедшей на титрование при pH 10 и при pH 12.
2.6 Методика определения обменной кислотности
Навеску почвы, пропущенной через сито с отверстиями диаметром 1-2 мм, массой 40 г помещают в колбу вместимостью 250 мл. В колбу приливают 100 мл 1М раствора KCl и взбалтывают в течение 1 ч. Часовое взбалтывание суспензии может быть заменено трехминутным взбалтыванием с последующим суточным настаиванием. Содержимое колбы фильтруют в сухую коническую колбу или другую емкость. Первые 10 мл фильтрата выбрасывают.
После того, как суспензия будет профильтрована полностью, 50 мл фильтрата помещают в коническую колбу вместимостью 250 мл, добавляют 2-3 капли фенолфталеина и титруют 0,02-0,1М раствором NaOH до появления розовой окраски, не исчезающей в течение 1 мин.
Обменную кислотность (Ноб ) рассчитывают по уравнению:
![]()
Где V и V1 – объем NaOH, пошедший на титрование соответственно аликвоты вытяжки и контрольной пробы; н – молярная концентрация NaOH, ммоль/мл; Vал и V0 – объем аликвоты вытяжки и общий объем добавленного к почве 1М KCl, мл; m - навеска почвы, г.
Реагенты:
1М раствор KClрастворяют в 300-400 мл дистиллированной воды, раствор фильтруют и объем доводят до 1 л. Значение рН раствора соответствует 5,6-6,0 (рН дистиллированной воды, находящейся в равновесии с СО2 атмосферного воздуха, имеет рН около 5,6).
2.7 Методика определения гидролитической кислотности
В сухую колбу вместимостью 250 мл помещают навеску почвы, пропущенной через сито с отверстиями диаметром 1 мм, массой 40,0 г. В колбу приливают 100 мл 1М раствора СН3 СООNa и взбалтывают в течение часа. Часовое взбалтывание может быть заменено 3 минутным с последующим 18-20 часовым настаиванием с периодическим (4-5 раз) взбалтыванием суспензии. Суспензию взбалтывают круговыми движениями и фильтруют через сухой складчатый фильтр. Первые порции (около 10 мл) фильтрата выбрасывают. Если затем при фильтровании получают мутный раствор, его перефильтровывают. Аликвоту фильтрата 50 мл помещают в коническую колбу вместимостью 250 мл, добавляют 2-3 капли фенолфталеина и титруют 0,02-0,1 н раствором NaOH до слабо-розовой окраски, не исчезающей в течение 1 мин. Гидролитическую кислотность рассчитывают по уравнению:
Нг моль(+)/100 г почвы = [VнV0 100]/[Vал m],
Где V и н – объем и концентрация раствора NaOH, ммоль/мл; Vал - объем аликвоты вытяжки, мл; V0 – объем добавленного к навеске почвы раствора ацетата натрия, мл; m - навеска почвы, г. Если полученный результат умножают на 1,75 для компенсации неполного извлечения из почв кислотных компонентов при однократной обработке почвы экстрагирующим раствором, в комментарии к результатам анализа делают соответствующую оговорку.
Реагенты:
1М раствор СН3 СООNa с рН 8,3. Навеску ацетата натрия 82,0 г СН3 СООNa или 136,0 г СН3 СООNax3Н2 О растворяют в дистиллированной воде ,(если необходимо, фильтруют), доводят объем до 1 л и измеряют рН. Величину рН доводят до 8,3 растворами СН3 СООNa или NaOH с массовой долей 10%. Контроль рН раствора может быть осуществлен с помощью фенолфталеина. Раствор ацетата натрия при добавлении фенолфталеина должен иметь слабо-розовую окраску.
2.8 Методика определения концентрации фосфатов в 0,03 н. K 2 SO 4 -вытяжках (по Карпинскому – Замятиной)
Навеску почвы массой 20,0 г помещают в сухую колбу или другую емкость вместимостью 250 мл. К почве с помощью мерного цилиндра приливают 100 мл. 0,03 н. раствора K2 SO4 . Содержимое колбы взбалтывают 5 мин и фильтруют через складчатый фильтр в сухую коническую колбу. Чтобы получить прозрачные фильтраты, на фильтр переносят как можно больше почвы. Первые порции фильтрата могут опалесцировать, их перефильтровывают. Вытяжка должна быть прозрачной.В полученной 0,03 н. K2 SO4 -вытяжке определяют концентрацию фосфатов. Для этого в мерную колбу вместимостью 50 мл. помещают 20-40 мл. вытяжки. В колбу добавляют 8 мл. реагента Б. Объем жидкости в колбе доводят дистиллированной водой до метки, тщательно перемешивают и через 10 мин. Измеряют оптическую плотность раствора при длине волны 630-882 нм.
Перед окрашиванием анализируемого раствора необходимо приготовить шкалу стандартных растворов для получения градуировочной кривой. С этой целью в мерные колбы вместимостью 50 мл. приливают по 2 мл. 0,6 н. K2 SO4 , что обеспечит концентрацию сульфата калия в находящемся в колбе растворе приблизительно такую же, какую получают при анализе 40 мл K2 SO4 -вытяжки. Затем в каждую из колб с помощью бюретки приливают стандартный раствор с содержанием фосфора 0,005 мг P в 1 мл. В колбы добавляют 0,5; 1,0; 3,0; 5,0; 7,0 и 10,0 мл стандартного раствора. В колбы приливают дистиллированную воду приблизительно до объема 35 – 40 мл, реагент Б. Содержимое колб тщательно перемешивают, через 10 мин измеряют оптическую плотность и строят градуировочную кривую в координатах: оптическая плотность – количество фосфора в мерной колбе. По градуировочной кривой находят концентрацию фосфора в анализируемых растворах. Результаты анализа выражают в мг/л:
P, мг/л = Cp 1000/Vал ,
где Vал – объем аликвоты вытяжки, мл; Сp – число миллиграммов фосфора в мерной колбе, мг/объем мерной колбы.
3 Экспериментальная часть
В экспериментальной части проводился анализ почвы. Почва была отобрана в Усманском районе, Липецкой области. Проба отбиралась с глубины около 20 см, масса пробы составила 0,5 кг.
3.1 Определение гигроскопической влаги
1. Таблица полученных результатов:
Масса бюкса, г |
Масса бюкса с почвой, г |
Масса почвы m, г |
Масса бюкса после сушки, г |
Масса высушенной почвы m1 , г |
Гигроскопическая влага, % |
| 27,54575 | 29,21100 | 1,66255 | 30,12541 | 1,21441 | 36,90 |
| 33,18410 | 35,38934 | 2,205240 | 36,54123 | 1,65181 | 33,50 |
| 41,38525 | 44,54641 | 3,16116 | 45,65941 | 2,29531 | 35,40 |
ωср , % = 35,30%
2. Статистическая обработка данных.
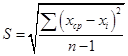 - стандартное отклонение
- стандартное отклонение
![]() 1.394
1.394
Sr = S/xср - относительное стандартное отклонение
Sr = 1.394/35.3 = 0.039
![]()
![]()
ω![]() ∆ω = (35.30
∆ω = (35.30![]() 3.46) %.
3.46) %.
3.2 Определение C и органических соединений по Тюрину
Vхол =40 мл
Vраб =10 мл
а=0,5 г
С%=(30*0,2*0,003*100)/0,5=3,6%
2. Определение фенола
Таблица полученных результатов
| Сфенола мкг/мл | Аоптическая плотность |
| 5 | 0.07 |
| 23 | 0.148 |
| 42.7 | 0.254 |
| 70 | 0.338 |
| х | 0.160 |
Градуировочный график
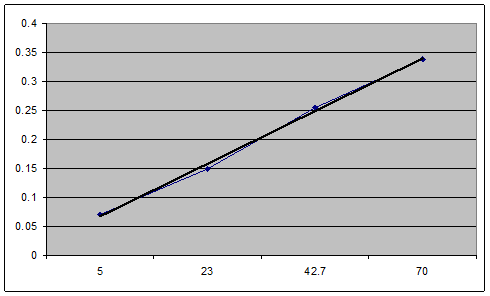
Из графика видно, что
| № | Ах | Сх, мкг/мл |
| 1 | 0,160 | 38 |
| 2 | 0,180 | 40 |
| 3 | 0,190 | 43 |
| ср | 0,176 | 40 |
Статистическая обработка данных.
S=![]()
![]() =2,08
=2,08
Sr = 2,08/40 = 0,052
![]()
С![]() ∆С = (40
∆С = (40![]() 0,5)мкг/мл
0,5)мкг/мл
Пересчитаем концентрацию: С=0,02г/20г почвы
3.3 Определение общей щелочности и щелочности, обусловленной карбонат-ионами
1. Таблица полученных результатов:
| № п/п | Масса навески, г |
Объем вытяжки, мл |
Объем титранта 0,01 М H2 SO4 , мл | ||
| общий | аликвота | По ф/ф | По м/о | ||
| 1 | 40 | 100 | 25 | 1,01 | 7,3 |
| 2 | 1,02 | 7,8 | |||
| 3 | 1,04 | 8,0 | |||
| ср | 1,03 | 7,9 | |||
2. Карбонатная щелочность.
![]() ;
;
![]()
![]() 0.404ммоль/100г, почвы
0.404ммоль/100г, почвы
![]() 0,408ммоль/100 г почвы
0,408ммоль/100 г почвы
![]() 0,416 ммоль/100г почвы
0,416 ммоль/100г почвы
![]() ммоль/100 г почвы
ммоль/100 г почвы
![]() 0,404*0,03*100=1,212%
0,404*0,03*100=1,212%
![]() 0,408*0,03*100=1,44%
0,408*0,03*100=1,44%
![]() 0,416*0,03*100=1,248%
0,416*0,03*100=1,248%
![]() =1,301
=1,301
Статистическая обработка данных.
S=![]()
![]() =0,0031
=0,0031
Sr = 0,0031/0,409 = 0,006
![]()
С![]() ∆С = (0,409
∆С = (0,409![]() 0,024)ммоль/100г почвы.
0,024)ммоль/100г почвы.
3.4 Общая щелочность
ОЩ1=![]() =1,662 ммоль/100г почвы
=1,662 ммоль/100г почвы
ОЩ2=![]() =1,764 ммоль/100г почвы
=1,764 ммоль/100г почвы
ОЩ3=![]() 1,808ммоль/100г почвы
1,808ммоль/100г почвы
ОЩср=1,745 ммоль/100г почвы
![]() =1,662*0,061*100=10,14%
=1,662*0,061*100=10,14%
![]() =1,764*0,061*100=10,76%;
=1,764*0,061*100=10,76%;
![]() =1,808*0,061*100=11,03%;
=1,808*0,061*100=11,03%;
![]() =1,745*0,061*100=10,65%.
=1,745*0,061*100=10,65%.
Статистическая обработка данных.
S=![]() 0.06
0.06
Sr = 0,06/1,808 = 0,033
Т=![]() =0,14
=0,14
С![]() ∆С = (1,808
∆С = (1,808![]() 0,14) ммоль/100г почвы.
0,14) ммоль/100г почвы.
3.5 Валовое содержание железа
1. Таблица полученных результатов:
| №п/п | Навеска почвы, г |
Объем аликвоты, мл |
Объем титранта, мл |
| 1 | 20 | 25 | 12,0 |
| 2 | 11,5 | ||
| 3 | 12,0 | ||
| ср | 11,8 |
![]() =0,0040н
=0,0040н
![]() =0,0038н
=0,0038н
![]() =0,0042н
=0,0042н
![]() =0,004н
=0,004н
С учетом разбавления:
С1 = 0,0080 моль/л
С2 = 0,0076 моль/л
С3 = 0,0084 моль/л
Сср = 0,0080 моль/л.
mFe 3+ = 0,0080·56·0,1 = 0,0448 г.
ω, %=![]() =0,224%
=0,224%
2. Статистическая обработка данных.
S=![]() =0,002
=0,002
Sr = 0,002/0,0080 = 0,25
Т=![]() =0,004
=0,004
С![]() ∆С = (0,0080
∆С = (0,0080![]() 0,004)моль/л.
0,004)моль/л.
3.6 Определение кальция и магния при совместном присутствии
1. Определение суммы кальция и магния
СТ = 0,1 моль-экв/л
Vал = 10 мл
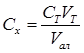
| № опыта | Vт , мл | С∑ моль экв/л |
| 1 | 2,05 | 0,0205 |
| 2 | 2,10 | 0,0210 |
| 3 | 1,95 | 0,0195 |
| ср | 2,03 | 0,0203 |
Статистическая обработка результатов
S=![]() =0,00026
=0,00026
Sr = 0,00026/0,0203 = 0,0128
Т=![]() =0,00061
=0,00061
Ср ср ±ΔC=(0,02030 ± 0,00061)ммоль экв/мл
m∑ = 0,056 + 0,0128 = 0,069
ω%=0,203%
2. Определение кальция
Vал = 10 мл
Ст = 0,1 моль экв/л
№ опыта |
Vт , мл | СCa2+ моль экв/л |
| 1 | 1,38 | 0,0138 |
| 2 | 1,36 | 0,0136 |
| 3 | 1,32 | 0,0132 |
| ср | 1,36 | 0,0136 |
Статистическая обработка результатов
S=![]() =0,0015
=0,0015
Sr = 0,0015/0,0136 = 0,11
Т=![]() =0,0037
=0,0037
Ср ср ± ΔC = (0,0136 ± 0,0037)ммоль экв/мл
ω%=mCa / mн
mCa = 0.0136·40·0.1 = 0,0544 г
ω%=0,19%
3.Определение магния
Vал = 10 мл
Ст = 0,1 моль экв/л
| № опыта | Vт , мл | СMg 2+ моль экв/л |
| 1 | 0,71 | 0,0071 |
| 2 | 0,73 | 0,0073 |
| 3 | 0,74 | 0,0074 |
| ср | 0,72 | 0,0072 |
Статистическая обработка результатов
S=![]() =0.00024
=0.00024
Sr =0,00024/0,0072 = 0,033
Т=![]() =0.00054
=0.00054
Ср ср ± ΔC = (0,0072 ± 0,00054)ммоль экв/мл
mMg = 0,0072·24·0,1 = 0,01761 г
ω%=0,071%
3.7 Определение обменной кислотности
1. Таблица полученных данных
| № п/п | Vт | Vал | mнав | V0 | Ноб, ммоль(+)/100г почвы |
| 1 | 2,7 | 50 | 40 | 100 | 1,47 |
| 2 | 2,73 | 1,43 | |||
| 3 | 2,67 | 1,32 | |||
| Cр | 2,69 | 1,40 |
2. Статистическая обработка результатов
S=![]() =0,03
=0,03
Sr =0,03/1,40 = 0,028
Т=![]() =0.02
=0.02
Ср ср ±ΔC=(1,40±0,020)ммоль/100 г почвы
3.8 Определение концентрации фосфатов в 0,03 н. K 2 SO 4 -вытяжках (по Карпинскому – Замятиной )
1. Построение градуировочного графика.
График: оптическая плотность – объем аликвоты.
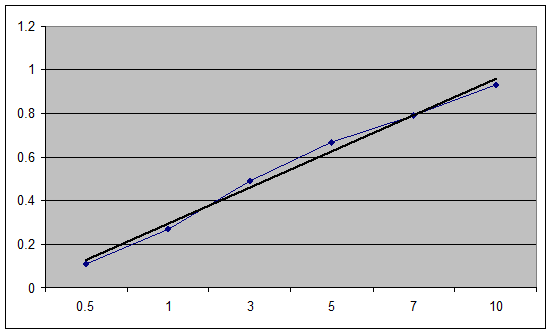
| Vал | Оптическая плотность, Аср |
| 0.5 | 0.11 |
| 1 | 0.27 |
| 3 | 0.49 |
| 5 | 0.67 |
| 7 | 0.79 |
| 10 | 0.93 |
| х | 0,53 |
С1
=![]() = 3,25 мг/100 г;
= 3,25 мг/100 г;
С2
= ![]() =3,27 мг/100 г;
=3,27 мг/100 г;
С3
= ![]() =3,29 мг/100 г.
=3,29 мг/100 г.
Сср = 3,27 мг/100 г = 3,27·10-3 г/100 г
ω%=( Ср ср /10)·100% = 0,0327%
2. Статистическая обработка результатов
S=![]() =0,016
=0,016
Sr =0,016/3,27 = 0,048
Т=![]() =0,039
=0,039
Ср ср ±ΔC=(3,27±0,039)мг/100 г
3. 9 Определение гидролитической кислотности
1. Таблица полученных результатов
| № опыта | Vт | Vал | mнав | V0 | Нгидр ммоль(+)/100г почвы |
| 1 | 1,17 | 50 |
40 | 100 | 0,61 |
| 2 | 1,22 | 0,56 | |||
| 3 | 1,19 | 0,51 | |||
| Cр | 1,19 | 0,51 |
2. Статистическая обработка результатов
S=![]() =0,018
=0,018
Sr =0,018/0,51 = 0,02
Т=![]() =0.059
=0.059
Ср ср ±ΔC=(0,51±0,059)ммоль/100 г почвы.
3.10 Определение нитрат ионов в почве с использованием нитрат селективного электрода
Результаты определений занесены в таблицу:
| С, моль/л | Е, В | -lg C |
| 0,1 | 306.0 | 1 |
| 0,01 | 357.7 | 2 |
| 0,001 | 413.8 | 3 |
| 0,0001 | 462.6 | 4 |
По результатам построен график 1.
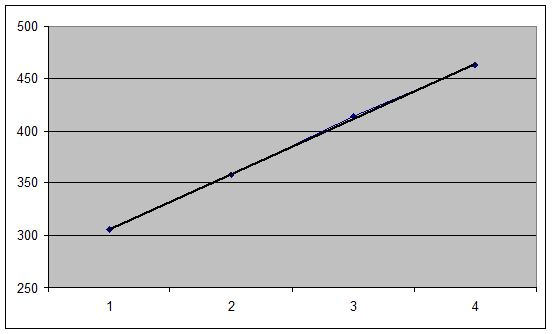
Концентрации найденные по градуировочному графику приведены в таблице:
| № определения | Е, В | -lg C | С, моль/л |
| 1 | 457,2 | 3,86 | 0,000138 |
| 2 | 457,5 | 3,88 | 0,000132 |
| 3 | 455,7 | 3,87 | 0,000135 |
| ср | 455,7 | 3,87 | 0,000135 |
Статистическая обработка результатов
S=![]() =0,00006
=0,00006
Sr =0,00006/0,000135 = 0,04
Т=![]() =0.009
=0.009
Ср ср ±ΔC=(0,000135±0,009)ммоль/100 г почвы.
Пересчитаем концентрацию:
с = сNO 3 *14*105 /1-(w/100)
С=0,000135*15/1-(35,3/100)=0,034мг/кг
Заключение
В ходе данной работы был проанализирован образец почвы, отобранный в Усманском районе Липецкой области. Полученные результаты представлены в таблице:
Определяемый показатель |
Содержание в образце почвы |
Определяемый показатель |
Содержание в образце почвы |
Гигроскопическая влага |
35,3% | Содержание кальция и магния | 0,203% |
Содержание фенола |
0,02г/20г почвы | Содержание кальция | 0,19% |
Карбонатная щелочность |
0,409ммоль/100г почвы | Содержание магния | 0,071% |
Общая щелочность |
1,808ммоль/100г почвы | Гидролитическая кислотность |
1,40/100г почвы |
Содержание железа |
0,224% | Обменная кислотность | 0,51 ммоль/100г почвы |
Содержание фосфатов |
0,0327% | Содержание углерода | 3,6% |
Библиографический список
1 Химический анализ почв/ Воробьева Л.А. – М.: изд. МГУ, 1998. – 272с.: ил.
2 Эколого-аналитический мониторинг стойких органических загрязнителей/ Майстренко В.Н., Клюев Н.А. – М.: Мир: БИНОМ. Лаборатория знаний, 2004. -323с.: ил.
3 Основы аналитической химии. Практическое руководство: уч. Пособие для ВУЗов/ Фадеева В.И., Шеховцова Т.Н., Иванов В.М. и др.; под ред. Золотова Ю.А. – М.: Высшая школа, 2001. – 463с: ил.
4 Агрохимические исследования почв/Под ред. А.В.Соколова. М.: Наука, 1975. 98 с.
5 Учебно-полевая практика и лабораторные работы,методическое пособие/Дербенцева А.М.,Пилипушка В.Н.-Владивосток,2005.-24с.
6 Практикум по агрохимии/Под ред. МинееваВ.Г. М.:Изд-во МГУ,2001.-689 с.
Похожие работы
-
Сравнительная оценка влияния различных доз азотных удобрений на урожай и качество салата
Министерство сельского хозяйства Российской Федерации Департамент научно-технической политики и образования Федеральное государственное образовательное учреждение высшего профессионального образования
-
Гидролиз солей. Особенности почвенного гидролиза
Характеристика гидролиза солей. Виды реакций нейтрализации между слабыми и сильными кислотами и основаниями. Почвенный гидролиз солей и его значение в сельском хозяйстве. Буферная способность почвы: обмен катионов и анионов в процессе минерализации.
-
Физические свойства эфирных масел
Эта группа веществ получила свое название еще в XVIII веке, задолго до того, как был определен их химический состав. Эфирными они названы из-за их испаряемости и летучести (как эфир), а маслами — так как они жирные на ощупь, легче воды и не смешиваются с ней. Накопление эфирных масел в растениях зависит от различных факторов: климата, света, почвы, фазы развития растений, их возраста и др.
-
Классификация химических элементов по Гольдшмидту. Геохимические барьеры
Московский Государственный Открытый Университет Контрольная работа по дисциплине: Геохимия Москва 2010 г. Геохимическая классификация химических элементов по Гольдшмидту
-
Минеральные удобрения
Для повышения урожайности сельскохозяйственных культур огромное значение имеет внесение в почву элементов, необходимых для роста и развития растений. Эти элементы вносятся в почву в виде
-
Химия в сельском хозяйстве и её направления
Химия в сельском хозяйстве и её направления Химизация — это одно из направлений научно-технического прогресса, основанное на широком применении химических веществ, процессов и методов в различных отраслях, например в сельском хозяйстве.
-
Определение содержания в почве сульфат-ионов
Общие сведения о сульфатных соединениях. Получение водного раствора сульфатов. Опрессование, центрифугирование, вытеснение, вакуум-фильтрационный и лизиметрический метод. Методики количественного и качественного анализа наличия сульфата в растворе.
-
Умягчение воды анионированем
Процесс и схематическое изображение умягчения воды методом натрий-хлор-ионирования. Сущность и условия применения способа умягчения воды аммоний-ионированием. Методы глубокого умягчения воды. Катионирование в фильтрах с гидравлически зажатой загрузкой.
-
Железо в почвах. Методы определения железа
Методы определения железа в почвах: атомно-абсорбционный и комплексонометрический. Соотношение групп соединений железа в различных почвах. Методики определения подвижных форм железа с помощью роданида аммония. Эталонные растворы для проведения анализа.
-
Анализ почв и агрохимический анализ
Сущность агрономической химии. Особенности почвы, система показателей химического состава, принципы определения и интерпретации. Методы определения приоритетных загрязняющих веществ. Анализ растений. Определение видов и форм минеральных удобрений.