Название: Растворимость солей, кислот и оснований в воде (таблица)
Вид работы: реферат
Рубрика: Химия
Размер файла: 273.06 Kb
Скачать файл: referat.me-369279.docx
Краткое описание работы: Растворимость солей, кислот и оснований в воде Ионы – растворяется (>1г на 100г – не растворяется ( – в водной среде разлагается
Растворимость солей, кислот и оснований в воде (таблица)
Растворимость солей, кислот и оснований в воде
| Ионы | |||||||||||||||
| Р | Р | - | Р | М | Н | Н | Н | - | Н | Н | Н | Н | Н | ||
| Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | |
| Р | Р | Р | Н | Р | Р | Р | Р | Р | Р | М | Р | Р | Р | Р | |
| Р | Р | Р | Н | Р | Р | Р | Р | Р | Н | Н | Р | ? | Р | ? | |
| Р | Р | Р | Н | - | - | - | Н | Н | Н | Н | Н | - | - | - | |
| Р | Р | Р | Н | Н | Н | М | М | ? | Н | Н | Н | ? | ? | - | |
| Р | Р | Р | М | Н | М | Р | Р | Р | - | Н | Р | Р | Р | Р | |
| Р | Р | Р | Н | Н | Н | Н | Н | Н | ? | Н | Н | ? | ? | ? | |
| Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | Н | ? | ? | ? | |
| Р | Р | Р | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | |
| Р | Р | Р | Р | М | Н | Н | Р | Р | - | Н | Н | Н | М | Н |
Р
– растворяется (>1г на 100г ![]() Н
– не растворяется (<0,1г на 100г
Н
– не растворяется (<0,1г на 100г ![]()
![]() -
– в водной среде разлагается M
– мало растворяется (от 0,1г до 1г на 100г
-
– в водной среде разлагается M
– мало растворяется (от 0,1г до 1г на 100г ![]() (С) Панарин О.В., 2001.
(С) Панарин О.В., 2001.
? – нет достоверных сведений о существовании соединения
Сильные и слабые электролиты
| Сильные | Слабые |
| 1. Все растворимые соли. | 1. Все труднорастворимые соли. |
2.
Неорганические кислоты
:
|
2. Неорганические кислоты
:
|
| 3.
Щелочи:
|
3. Амфотерные основания:
4. Неамфотерные гидроксиды:
5. Органические кислоты:
6.
|
Электролиз
| Расплавов солей, оснований | Растворов солей, гидроксидов и кислот |
Бескислородный анион (пример): A(+):
Кислородсодержащий анион (пример): A(+):
|
Li K Ca Na Mg Al Mn Zn Cr Te Ni Sn Pb H Cu Hg Ag Pt Au I группа II группа III группа I группа:
K(-):
II группа:
K(-):
III группа:
K(-):
Анион бескислородной кислоты (пример): A(+):
Кислородосодержащий анион (пример): A(+):
|
Молекулярные массы неорганических соединений
| Ионы | ||||||||||||||||
| – | – | 62 | 94 | 153 | 56 | 40 | 102 | 152 | 72 | 160 | 71 | 81 | 80 | 232 | 223 | |
| 18 | 35 | 40 | 56 | 171 | 74 | 58 | 78 | 103 | 90 | 107 | 89 | 99 | 98 | 125 | 241 | |
| 36,5 | 53,5 | 58,5 | 74,5 | 208 | 111 | 95 | 138,5 | 158,5 | 127 | 162,5 | 126 | 136 | 135 | 143,5 | 278 | |
| 81 | 98 | 103 | 119 | 297 | 200 | 184 | 267 | 292 | 216 | 296 | 215 | 225 | 224 | 188 | 367 | |
| 128 | 145 | 150 | 166 | 391 | 294 | 278 | 408 | 433 | 310 | 437 | 309 | 319 | 318 | 235 | 461 | |
| 63 | 80 | 85 | 101 | 261 | 164 | 148 | 213 | 238 | 180 | 242 | 179 | 189 | 188 | 170 | 331 | |
| 34 | 68 | 78 | 110 | 169 | 75 | 56 | 150 | 200 | 88 | 208 | 87 | 97 | 96 | 248 | 239 | |
| 82 | 116 | 126 | 158 | 217 | 120 | 104 | 294 | 344 | 136 | 352 | 135 | 145 | 144 | 296 | 287 | |
| 98 | 132 | 142 | 174 | 233 | 136 | 120 | 342 | 392 | 152 | 400 | 151 | 161 | 160 | 312 | 303 | |
| 62 | 96 | 106 | 138 | 197 | 100 | 84 | 234 | 284 | 116 | 292 | 115 | 125 | 124 | 276 | 267 | |
| 78 | 112 | 122 | 154 | 213 | 116 | 100 | 282 | 332 | 132 | 340 | 131 | 141 | 140 | 292 | 283 | |
| 98 | 149 | 164 | 212 | 601 | 310 | 262 | 122 | 147 | 358 | 151 | 355 | 385 | 382 | 419 | 811 |
Порядок заполнения электронами атомных орбиталей1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d 7p 8s |
![]()
![]()
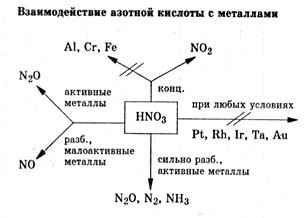
Ряд электоотрицательности неметаллов
Si, As, H, P, Se, I, C, S, Br, Cl, N, O, F
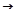 усиление элекроотрицательности
усиление элекроотрицательности
Электрохимический ряд напряжений металлов
Li, Rb, K, Ba, Sr, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe, Cd, Co, Ni, Sn, Pb, H , Sb, Bi, Cu, Hg, Ag, Pd, Pt, Au.
Version 4.0
Без разрешения автора копировать запрещается (достаточно отправить сообщение об использовании на е-mail: mailto:[email protected])
Похожие работы
-
Пластмассы 3
ПЛАСТМАССЫ Название CH3 Термопластичен. Обладает свойствами высокой ударной прочности, высокой стойкости к многократным изгибам, низкой паро- и газопроницаемости; хороший диэлектрик, плохо проводит тепло, не растворяется в органических растворителях, устойчив к воздействию кипящей воды и щелочей, но темнеет и разрушается под действием HNO3,
-
Сульфиды во всем многообразии
Методы получения сульфидов. Физико-химические свойства сульфидов металлов. Растворимость сульфидов. Основные химические свойства сульфидов. Тиосоли. Полисульфиды. Промышленное применение сульфидов.
-
Кислотно-основные индикаторы
Подбор кислотно-основных индикаторов в зависимости от рассчитанных параметров протолитических ТКТ. Ионная и хромофорная теории, их синтез. Изменение окраски индикатора. Момент окончания титрования. Правильный выбор индикатора. Индикаторные погрешности.
-
Кислотно-основное титрование (протолитометрия)
Титриметрия с использованием кислотно-основной реакции (реакции нейтрализации) – протолитометрия. Прямое, обратное и косвенное титрование. Водный и неводный варианты. Буферный раствор. Зеркально-симметричный график и линия нейтральности и эквивалентности.
-
Аминокислоты, их классификация
Аминокислоты - класс органических соединений, содержащих карбоксильные (-COOH) и аминогруппы (-NH2); обладают свойствами и кислот, и оснований. Участвуют в обмене азотистых веществ всех организмов (исходное соединение при биосинтезе гормонов.
-
Экзаменационные билеты по химии (Ангарск, 2003г.)
ЭКЗАМЕНАЦИОННЫЕ БИЛЕТЫ ПО ХИМИИ Билет№1 1) П.З. и П.С.Х.Э. Д.И.Менделеева. Закономерности изменения свойств элементов малых периодов и главных подгрупп в зависимости от атомного (порядкового) номера.
-
Основания
Муниципальное общеобразовательное учреждение. Вечерняя (сменная) общеобразовательная школа. Пос. Кавалерово Приморского края. РЕФЕРАТ По химии.
-
Химические реакции
Содержание. стр. 1. Химические реакции. 2. Окислительно-восстановительные реакции. 3. Реакции в растворах электролитов. 4. Представление о кислотах и основаниях.
-
Дисперсные системы, электролиты, РН показатель
Министерство общего и профессионального образования Российской Федерации. ОмГТУ Кафедра Химии. Реферат по курсу «Химия». Выполнил: Студент МСФ С-110
-
Расчет и построение ТКТ, выбор оптимального индикатора и определение индикаторной погрешности при титровании
Прямое титрование в протолиметрии. Водный и неводный варианты. Четыре основных случая протолиметрического титрования. Выбор оптимального индикатора и определение индикаторной погрешности. Процент оттитрования. Редокс-индикатор. Титруемое вещество.