Название: Квантовые числа
Вид работы: лабораторная работа
Рубрика: Химия
Размер файла: 35.25 Kb
Скачать файл: referat.me-369444.docx
Краткое описание работы: Квантовые числа - энергетические параметры состояния электрона и тип атомной орбитали. Главное квантовое число - n. Орбитальное квантовое число - l. Магнитное квантовое число - ml. Спиновое квантовое число - ms.
Квантовые числа
Квантовые числа – это энергетические параметры, определяющие состояние электрона и тип атомной орбитали, на которой он находится. Квантовые числа необходимы для описания состояния каждого электрона в атоме. Всего 4-ре квантовых числа. Это: главное квантовое число – n , орбитальное квантовое число – l , магнитное квантовое число – ml и спиновое квантовое число – ms .
Главное квантовое число – n .
Главное квантовое число – n – определяет энергетический уровень электрона, удалённость энергетического уровня от ядра и размер электронного облака. Главное квантовое число принимает любые целочисленные значения, начиная с n =1 ( n =1,2,3,…) и соответствует номеру периода.
Орбитальное квантовое число – l .
Орбитальное квантовое число – l – определяет геометрическую форму атомной орбитали. Орбитальное квантовое число принимает любые целочисленные значения, начиная с l =0 ( l =0,1,2,3,… n -1). Независимо от номера энергетического уровня, каждому значению орбитального квантового числа соответствует орбиталь особой формы. “Набор” таких орбиталей с одинаковыми значениями главного квантового числа называется энергетическим уровнем. Каждому значению орбитального квантового числа соответствует орбиталь особой формы. Значению орбитального квантового числа l =0 соответствует s -орбиталь (1-ин тип). Значению орбитального квантового числа l =1 соответствуют p -орбитали (3-ри типа). Значению орбитального квантового числа l =2 соответствуют d -орбитали (5-ть типов). Значению орбитального квантового числа l =3 соответствуют f -орбитали (7-мь типов).
| Значение орбитального квантового числа – l. | Типы орбитали. |
Количество типов орбитали. |
| l =0 | s- орбиталь | 1 |
| l =1 | p- орбитали | 3 |
| l =2 | d- орбитали | 5 |
| l =3 | f- орбитали | 7 |
![]()


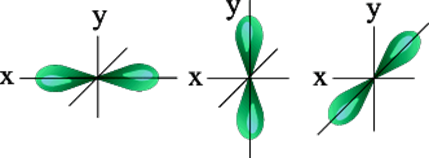


f-орбитали имеют ещё более сложную форму. Каждый тип орбитали – это объём пространства, в котором вероятность нахождения электрона – максимальна.
Магнитное квантовое число – ml .
Магнитное квантовое число – ml – определяет ориентацию орбитали в пространстве относительно внешнего магнитного или электрического поля. Магнитное квантовое число принимает любые целочисленные значения от –l до +l, включая 0. Это означает, что для каждой формы орбитали существует 2l+1 энергетически равноценных ориентаций в пространстве – орбиталей.
Для s-орбитали:
l=0, m=0 – одна равноценная ориентация в пространстве (одна орбиталь).
Для p-орбитали:
l=1, m=-1,0,+1 – три равноценные ориентации в пространстве (три орбитали).
Для d-орбитали:
l=2, m=-2,-1,0,1,2 – пять равноценных ориентаций в пространстве (пять орбиталей).
Для f-орбитали:
l=3, m=-3,-2,-1,0,1,2,3 – семь равноценных ориентаций в пространстве (семь орбиталей).
Спиновое квантовое число – ms .
Спиновое квантовое число – ms – определяет магнитный момент, возникающий при вращении электрона вокруг своей оси. Спиновое квантовое число может принимать лишь два возможных значения +1/2 и –1/2. Они соответствуют двум возможным и противоположным друг другу направлениям собственного магнитного момента электрона – спинам. Для обозначения электронов с различными спинами используются символы: 5 и 6 .
Похожие работы
-
Состояния и уровни многоэлектронных атомов Орбитали и термы Векторная модель
Состояния и уровни многоэлектронных атомов. Орбитали и термы. Векторная модель. Содержание (01) Орбитали. (02) Электронные орбитали атомов и молекул (АО и МО).
-
Билеты по химии
Билеты по химии и частичные ответы на некоторые из них Билет №1 Простые вещества . Количество вещества. Число Авогадро. Качественный анализ анионов и катионов.
-
Электронное строение атома Периодический закон
Лекция № 2 и 3 Электронное строение атома. Периодический закон. Квантово-механическая модель атома. Атомные орбитали. Квантовые числа. Правила заполнения электронами атомных орбиталей. Валентность.
-
Химические формулы соединений
Составление формул соединений кальция с водородом, фтором и азотом. Определение степени окисления атома углерода и его валентности. Термохимические уравнения реакций, теплота образования. Вычисление молярной концентрации эквивалента раствора кислоты.
-
Строение атома
Протоны и нейтроны как составляющие атомного ядра. Атомный номер элемента. Изотопы, ядерная и квантово-механическая модели атома. Волновые свойства электрона. Одноэлектронные и многоэлектронные атомы, квантовые числа. Электронная конфигурация атома.
-
Атом гелия. Двухэлектронный коллектив на примере атома гелия
Двухэлектронный коллектив на примере атома гелия. Волновые функции коллектива. Перестановочная симметрия. Спиновые волновые функции. Обозначение электронной конфигурации. Орбитальные состояния. Принцип минимума энергии. Орбитальное приближение.
-
Строение атома
Реферат по химии на тему "Строение атома" Существование закономерной связи между всеми химическими элементами, ярко выраженное в периодической системе, наталкивает на мысль о том, что в основе всех атомов лежит нечто общее, что все они находятся в близком родстве друг с другом. Однако до конца 19 в. в химии господствовало метафизическое убеждение, что атом есть наименьшая частица простого вещества, последний предел делимости материи.
-
Введение в теорию атома
Введение в теорию атома. Краткие математические сведения о сферических системах. Ротатор. Уравнение Шрёдингера для одноэлектронного атома (атом водорода и водородоподобные ионы).
-
Векторная модель многоэлектронного атома
Микросостояния и атомные термы в приближении Рассела-Саундерса, их систематизация. Порядок учёта кулоновских взаимодействий и постадийная классификация дискретных электронных уровней и состояний атома. Термы нормальные и обращённые. Правила Хунда.
-
Введение в теорию многоэлектронного атома. Элементы теории многоэлектронных атомов
Теория многоэлектронного атома. Атом H и водородоподобный ион. Возмущение потенциала и расщепление уровней АО. Правило Маделунга-Клечковского. Порядок учёта кулоновских взаимодействий. Микросостояния и атомные термы в приближении Рассела-Саундерса.