Название: Ферум Fe
Вид работы: реферат
Рубрика: Химия
Размер файла: 209.69 Kb
Скачать файл: referat.me-370027.docx
Краткое описание работы: Входить в склад дихальних пігментів, бере участь в переносі кисню до тканин в організмі тварин і людини, стимулює функцію кровотворних органів. В якості лікарського засобу приймається при анемічних і деяких інших патологічних станах.
Ферум Fe
Ферум (Fe)
Входить в склад дихальних пігментів, бере участь в переносі кисню до тканин в організмі тварин і людини, стимулює функцію кровотворних органів. В якості лікарського засобу приймається при анемічних і деяких інших патологічних станах.
Організм дорослої людини містить в середньому 4-5 г феруму, з них близько 70% знаходиться в складі гемоглобіну. Залізо, існуюче в плазмі крові, є транспортною формою заліза, яке зв‘язане з білком трансферином. Вміст заліза в плазмі крові підпорядкований добовим коливанням – він знижується в другій половині дня, обмін заліза в організмі багато в чому залежить від нормального функціонування печінки. Покази до приймання заліза є залізодефіцитні анемії різної етиології (анемії від крововтрат, хлороз, анемії вагітних), які проходять з пониженим вмістом заліза в крові, а також стан латентного безсимптомного дефіциту заліза зустрічається у 20-30% практично здорових жінок.
Препарати заліза можуть бути рекомендовані при довгому внутрішньо судинному гемолізі, супроводжуючому постійною втратою заліза, яке виводиться з сечею, при захворюваннях системи крові, складних кровотеч, з розвитком вторинної недостатності заліза.
Основними джерелами заліза в харчових продуктах є продукти тваринного походження (м‘ясо, риба, печінка). Серед препаратів заліза найбільше застосування отримали: залізо гліцерофосфат, залізо лактат, ферітал, заліза закисного сульфат, таблетки “Гемостимулін”.
d – елемент VІІІгрупи; порядковий номер 26; атомна маса – 56; (![]() ), 26е
), 26е![]() .
.
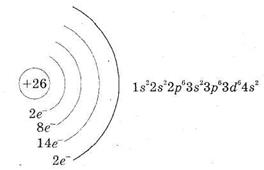
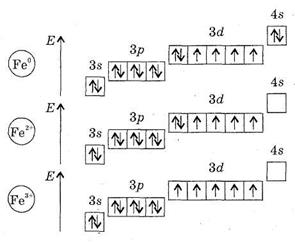
Метал середньої активності, відновник. Основні ступені окиснення - +2, +3.
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() ЗАЛІЗО
ЗАЛІЗО
Хімічні властивості:
1. На повітрі легко окисyюється в присутності вологи (ірзавіння)
4Fe+3O![]() +6H
+6H![]() O→4Fe(OH)
O→4Fe(OH)![]()
2. Залізний дріт горить у кисні, утворюючи окалину – оксид феруму (ІІ, ІІІ)
3Fe+2O![]() →Fe
→Fe![]() O
O![]()
3.При високій температурі (700-900![]() С) реагує з парою води:
С) реагує з парою води:
3Fe+4H![]() O→
O→![]() →Fe
→Fe![]() O
O![]() +4H
+4H![]() ↑
↑
4. Реагує з неметалами при нагріванні
2Fe+3Br![]() →
→![]() →2FeBr
→2FeBr![]()
Fe+S→![]() →FeO
→FeO
5.Легко розчиняється в хлорид ній і розведеній сульфатній кислотах
Fe+2HCl→FeCl![]() +H
+H![]() ↑
↑
Fe+H![]() SO
SO![]() (розв.)→FeSO
(розв.)→FeSO![]() +H
+H![]() ↑
↑
У концентрованих кислотах-окисниках залізо розчиняється тільки при нагріванні.
2Fe+6H![]() SO
SO![]() (конц.) →
(конц.) →![]() →Fe
→Fe![]() (SO
(SO![]() )
)![]() +3SO
+3SO![]() ↑+6H
↑+6H![]() O
O
Fe+6HNO![]() (конц.) →
(конц.) →![]() →Fe(NO
→Fe(NO![]() )
)![]() +3NO
+3NO![]() ↑+3H
↑+3H![]() O.
O.
(на холоді концентровані нітратна і сульфатна кислоти пасивують залізо).
6. Витісняє метали, що стоять правіше від нього в ряді напруг, із розчинів їх солей:
Fe+CuSO![]() →FeSO
→FeSO![]() +Cu↓
+Cu↓
Сполуки двовалентного феруму.
Гідроксид феруму (ІІ)
Одержання
При дії розчинів основ на солі феруму (ІІ) без доступу повітря
FeCl![]() +2KOH→2KCl+Fe(OH)
+2KOH→2KCl+Fe(OH)![]() ↓.
↓.
Хімічні властивості.
Fe(OH)![]() - слабка основа, розчиняється в сильних кислотах
- слабка основа, розчиняється в сильних кислотах
Fe(OH)![]() +H
+H![]() SO
SO![]() →FeSO
→FeSO![]() +2H
+2H![]() O
O
Fe(OH)![]() +2H
+2H![]() →Fe
→Fe![]() +H
+H![]() O
O
При прожарюванні Fe(OH)![]() без доступу повітря утворюється оксид феруму(ІІ) FeO
без доступу повітря утворюється оксид феруму(ІІ) FeO
Fe(OH)![]() →
→![]() →FeO+ H
→FeO+ H![]() O
O
У присутності кисню повітря білий осад Fe(OH)![]() , окислюючись, буріє – утворюється гідроксид феруму (ІІІ) Fe(OH)
, окислюючись, буріє – утворюється гідроксид феруму (ІІІ) Fe(OH)![]() .
.
4 Fe(OH)![]() +O
+O![]() +2H
+2H![]() O→4 Fe(OH)
O→4 Fe(OH)![]() .
.
Сполуки феруму (ІІ) мають відновні властивості, вони легко перетворюються на сполуки феруму (ІІІ) під дією окисників
10FeSO![]() +2KMnSO
+2KMnSO![]() +8H
+8H![]() SO
SO![]() →5Fe
→5Fe![]() (SO
(SO![]() )
)![]() +K
+K![]() SO
SO![]() +2MnSO
+2MnSO![]() +8H
+8H![]() O
O
6FeSO![]() +2HNO
+2HNO![]() +3H
+3H![]() SO→3Fe
SO→3Fe![]() (SO
(SO![]() )
)![]() +2NO↑+4H
+2NO↑+4H![]() O
O
Сполуки феруму схильні до комплексоутворення (кординаційне число=6)
FeCl![]() +6NH
+6NH![]() →[Fe(NH
→[Fe(NH![]() )
)![]() ]Cl
]Cl![]()
Fe(CN)![]() +4KCN→K
+4KCN→K![]() [Fe(CN)
[Fe(CN)![]() ] (жовта кров‘яна сіль).
] (жовта кров‘яна сіль).
Якісна реакція на Fe![]()
При дії гексаціоноферату (ІІІ) калію K![]() [Fe(CN)
[Fe(CN)![]() ] (червоної кров‘яної солі) на розчин солей двовалентного феруму утворюється синій осад (турнублева синь)
] (червоної кров‘яної солі) на розчин солей двовалентного феруму утворюється синій осад (турнублева синь)
3FeSO![]() +2 K
+2 K![]() [Fe(CN)
[Fe(CN)![]() ]→
Fe
]→
Fe![]() K
K![]() [Fe(CN)
[Fe(CN)![]() ]
]![]() ↓+3K
↓+3K![]() SO
SO![]()
3Fe![]() +3SO
+3SO![]() +6K
+6K![]() 2 K
2 K![]() [Fe(CN)
[Fe(CN)![]() ]
]![]() →Fe
→Fe![]() [Fe(CN)
[Fe(CN)![]() ]
]![]() ↓+6K
↓+6K![]() +3SO
+3SO![]()
3Fe![]() +2 [Fe(CN)
+2 [Fe(CN)![]() ]
]![]() → Fe
→ Fe![]() [Fe(CN)
[Fe(CN)![]() ]
]![]() ↓.
↓.
Гідроксид феруму (ІІІ)
Одержання
Утворюється при дії розчинів основ на солі тривалентного феруму – випадає у вигляді червоно-бурого осаду
Fe(NO![]() )
)![]() +3KOH→Fe(OH)
+3KOH→Fe(OH)![]() +3KNO
+3KNO![]()
Fe![]() +3OH
+3OH![]() →Fe(OH)
→Fe(OH)![]() ↓
↓
Хімічні властивості
Fe(OH)![]() - більш слабка основа, ніж гідроксид феруму (ІІ).
- більш слабка основа, ніж гідроксид феруму (ІІ).
Це зумовлено тим, що у Fe![]() менший заряд іона і більший його радіус, ніж у Fe
менший заряд іона і більший його радіус, ніж у Fe![]() , а тому Fe
, а тому Fe![]() слабше утримує гідроксид-іони, тобто Fe(OH)
слабше утримує гідроксид-іони, тобто Fe(OH)![]() легше дисоціює.
легше дисоціює.
Це зумовлено тим, що у Fe2+ менший заряд іона iбільший його радіус, ніж у Fe3+ , а тому Fe2+ слабше утримує гідроксид-іони, тобто Fe(OH)2 легше дисоціює.
У зв'язку з цим солі феруму (ІІ) гідролізуються незначно, а солі феруму (III) — дуже сильно. Гідролізом зумовлюється iколір розчинів солей Fe(III): незважаючи на те, що іон Fe3+ майже безбарвний, розчини, які його містять, забарвленя в жовто-бурий колір, що пов'язано з присутністю гідроксоіонів феруму або молекул Fe(OH)3 , що утворюються завдяки гідролізу:
Fe3+
+H![]() O↔[Fe(OH)]
O↔[Fe(OH)]![]() +H
+H![]()
[Fe(OH)]![]() + H
+ H![]() O↔[Fe(OH)
O↔[Fe(OH)![]() ]
]![]() +H
+H![]()
[Fe(OH)![]() ]
]![]() + H
+ H![]() O↔Fe(OH)
O↔Fe(OH)![]() +H
+H![]()
Принагріваннізабарвленнятемнішае, апридодаваннікислотсвітлішаєвнасладокпригніченнягідролізу. Fe(OH)3 характеризується слабко вираженою амфотерністю — він розчиняється в розведених кислотах i в концентрованих розчинах основ:
Fe(OH)![]() +3HCl
+3HCl![]() →FeCl
→FeCl![]() +3H
+3H![]() O
O
Fe(OH)![]() +3H
+3H![]() →Fe
→Fe![]() +3H
+3H![]() O
O
Fe(OH)![]() +NaOH→Na[Fe(OH)
+NaOH→Na[Fe(OH)![]() ]
]
Fe(OH)![]() +OH
+OH![]() →[Fe(OH)
→[Fe(OH)![]() ]
]![]()
Сполуки феруму (ІІІ) – слабкі окисники, реагують із сильними відновниками
2Fe![]() Cl
Cl![]() +H
+H![]() S
S![]() →S
→S![]() +2Fe
+2Fe![]() Cl
Cl![]() +2HCl.
+2HCl.
Якісні реакції на Fe![]()
При дії гексаціоноферату (ІІ) калію K![]() [Fe(CN)
[Fe(CN)![]() ] (жовтої кров‘яної солі) на розчин солей тривалентного феруму утворюється синій осад (берлінська лазур)
] (жовтої кров‘яної солі) на розчин солей тривалентного феруму утворюється синій осад (берлінська лазур)
4FeCl![]() +3K
+3K![]() [Fe(CN)
[Fe(CN)![]() ]→Fe
]→Fe![]() [Fe(CN)
[Fe(CN)![]() ]
]![]() ↓+12KCl
↓+12KCl
4Fe![]() +12Cl
+12Cl![]() +12K
+12K![]() +3[Fe(CN)
+3[Fe(CN)![]() ]
]![]() →Fe
→Fe![]() [Fe(CN)
[Fe(CN)![]() ]
]![]() ↓+12K
↓+12K![]() +12Cl
+12Cl![]()
4Fe![]() +3[Fe(CN)
+3[Fe(CN)![]() ]
]![]() →Fe
→Fe![]() [Fe(CN)
[Fe(CN)![]() ]
]![]() ↓
↓
При додаванні до розчину, що містить іони Fe![]() , роданистого калію або амонію, з‘являється інтенсивне криваво-червоне забарвлення роданіду феруму (ІІІ).
, роданистого калію або амонію, з‘являється інтенсивне криваво-червоне забарвлення роданіду феруму (ІІІ).
FeCl![]() +3NH
+3NH![]() CNS↔3NH
CNS↔3NH![]() Cl+Fe(CNS)
Cl+Fe(CNS)![]()
(при взаємодії ж із родінідами іонів Fe![]() розчин залишається практично безбарвним).
розчин залишається практично безбарвним).
Список використаної літератури
1. Розділ «ХІМІЯ» А.Загайко
Похожие работы
-
Мікроелементи Zn, Mn, Co, Cu, F, Br, J
Цинк як життєвоважливий мікроелемент для всіх вищих організмів. Характеристика марганцю, його значення. Йод – елемент, що міститься у всіх тканинах людини. Біологічна роль кобальту. Бром – постійна складова частина різних тканин організму людини і тварин.
-
Корисний вплив моно та полі ненасичених жирних кислот на організм людини. Набір продуктів, що їх
Міністерство освіти і науки України Дніпропетровський національний університет ім. О. Гончара Хімічний факультет Кафедра харчових технологій та інженерії
-
Перекисне окислення ліпідів
МІНІСТЕРСТВО ОСВІТИ І НАУКИ УКРАЇНИ ХАРКІВСЬКИЙ НАЦІОНАЛЬНИЙ УНІВЕРСИТЕТ ім. В.Н. Каразіна Кафедра органічної хімії КУРСОВА РОБОТА З ТЕМИ: Перекисне окислення ліпідів
-
Біогеохімічні цикли структура загальна характеристика цикли вуглецю азоту кисню сірки
Індекс групи ___________________ Орловський Олександр Володимирович м. Бровари Київської області вул. Київська 300в кв. 51 Приватний підприємець
-
Глюкоза и сахароза
ВУГЛЕВОДИ(САХАРИДИ) МОНОСАХАРИДИ ДИСАХАРИДИ ПОЛІСАХАРИДИ Гексози Альдози Сахароза Крохмаль Целюлоза Глюкоза Кетози Фруктоза Вуглеводи — природні сполуки, які відіграють важливу роль у житті людини, тварин і рослин. Вони дуже поширені в природі, особливо в рослинному світі: 80 % сухої маси рослин становлять вуглеводи.
-
Хімія та екологія
Реферат з хімії “” У живій і неживій природі відбуваються різні фізичні, хімічні та біологічні процеси, які у більшості випадків взаємозв’язані й перебувають у нестійкій рівновазі; спостерігається так званий колообіг хімічних елементів і речовин, наприклад кисню, води, оксиду карбону(IV)тощо.
-
Біотехнологія металів
Нові тенденції в розвитку біотехнології металів. Біонеметали і біометали. Хімічні елементи в складі живих організмів. Оцінка іонності і ковалентності зв'язків іонів біметалів за Б. Яцимірським. Характеристика основних напрямків розвитку біотехнології.
-
Оксиген і сульфур
Кисень - історія відкриття. Поширення в природі, одержання. Фізичні і хімічні властивості. Застосування кисню. Біологічна роль кисню. Сірка - хімічні властивості. Оксиди сульфуру. Сульфатна кислота. Чесна сірка і нечиста сила. Чорний порох.
-
Вітаміноподібні сполуки
Біологічно активні вітаміноподібні сполуки. Структурні компоненти вітамінів. Здатність синтезуватися у тканинах. Інозитол. Карнітин. Ліпоєва кислота. Параамінобензойна кислота. Біофлавоноїди. Пангамова кислота. Оротова кислота. Убіхінон. Вітамін U.
-
Вітаміни групи В
Загальна характеристика вітамінів, їх класифікація. Вітаміни групи В. Фізичні та хімічні властивості, їх джерела. Дія вітамінів на організм людини. Показання до застосування. Значення вітамінів в забезпеченні нормальної життєдіяльності людини.