Название: Пероксид водрода
Вид работы: реферат
Рубрика: Химия
Размер файла: 32.4 Kb
Скачать файл: referat.me-370146.docx
Краткое описание работы: Химические свойства Перокси́д водоро́да перекись водорода — простейший представитель пероксидов. Бесцветная жидкость с «металлическим» вкусом, неограниченно растворимая в воде, спирте и эфире. Концентрированные водные растворы взрывоопасны. Пероксид водорода является хорошим растворителем.
Пероксид водрода
Химические свойства
Перокси́д водоро́да (перекись водорода ), H2 O2 — простейший представитель пероксидов. Бесцветная жидкость с «металлическим» вкусом, неограниченно растворимая в воде, спирте и эфире. Концентрированные водные растворы взрывоопасны. Пероксид водорода является хорошим растворителем. Из воды выделяется в виде неустойчивого кристаллогидрата H2 O2 •2H2 O.
Молекула пероксида водорода имеет следующее строение:
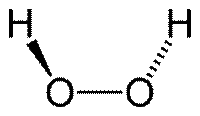 Молекула пероксида водорода сильно полярна, что приводит к возникновению водородных связей между молекулами. Связь O—O непрочна, поэтому H2
O2
— неустойчивое соединение, легко разлагается. Так же этому может поспособствовать присутствие ионов переходных металлов и серебра:
Молекула пероксида водорода сильно полярна, что приводит к возникновению водородных связей между молекулами. Связь O—O непрочна, поэтому H2
O2
— неустойчивое соединение, легко разлагается. Так же этому может поспособствовать присутствие ионов переходных металлов и серебра:
2H2 O2 → 2H2 O + O2
Однако очень чистый пероксид водорода устойчив.
Пероксид водорода проявляет слабые кислотные свойства (К = 1,4×10−12 ), и поэтому диссоциирует по двум ступеням:
![]()
При действии концентрированного раствора Н2 O2 на некоторые гидроксиды в ряде случаев можно выделить пероксиды металлов, которые можно рассматривать как соли пероксида водорода (Li2 O2 , MgO2 и др.):
Н2 O2 + 2NaOH → Na2 O2 + 2H2 O
H2 O2 + Ba(OH)2 → BaO2 ↓ + 2H2 O
Пероксид водорода может проявлять как окислительные, так и восстановительные свойства. Например, при взаимодействии с оксидом серебра он является восстановителем:
![]()
В реакции с нитритом калия соединение служит окислителем:
![]()
Пероксидная группа [—O—O—] входит в состав многих веществ. Такие вещества называют пероксидами, или пероксидными соединениями. К ним относятся пероксиды металлов (Na2 O2 , BaO2 и др.). Кислоты, содержащие пероксидную группу, называют пероксокислотами, например, пероксомонофосфорная H3 PO5 и пероксидисерная H2 S2 O8 кислоты.
Окислительно-восстановительные свойства
Пероксид водорода обладает окислительными, а также восстановительными свойствами. Он окисляет нитриты в нитраты, выделяет иод из иодидов металлов, расщепляет ненасыщенные соединения по месту двойных связей. Пероксид водорода восстанавливает соли золота и серебра, а также кислород при реакции с водным раствором перманганата калия в кислой среде.
При восстановлении Н2 O2 образуется Н2 O или ОН-, например: Н2 О2 + 2KI + H2 SO4 = I2 + K2 SO4 + 2H2 O
При действии сильных окислителей H2 O2 проявляет восстановительные свойства, выделяя свободный кислород:
O2 2− — 2e− → O2
Реакцию KMnO4 с Н2 O2 используют в химическом анализе для определения содержания Н2 O2 :
5H2 O2 + 2KMnO4 + 3H2 SO4 → 5O2 + 2MnSO4 + K2 SO4 + 8H2 O
Окисление органических соединений пероксидом водорода (например, сульфидов и тиолов) целесообразно проводить в среде уксусной кислоты.
Биологические свойства Перекись водорода относится к реактивным формам кислорода и при повышенном образовании в клетке вызывает оксидативный стресс. Некоторые ферменты, например глюкозоксидаза, образуют в ходе окислительно-восстановительной реакции пероксид водорода, который может играть защитную роль в качестве бактерицидного агента. В клетках млекопитающих нет ферментов, которые бы восстанавливали кислород до перекиси водорода. Однако несколько ферментных систем (ксантиноксидаза, НАД(Ф)H-оксидаза, циклоксигеназа и др.) продуцируют супероксид, который спонтанно или под действием супероксиддисмутазы превращается в перекись водорода.
Получение
Пероксид водорода получают в промышленности при реакции с участием органических веществ, в частности, каталитическим окислением изопропилового спирта:
(CH3 )2 СН(ОН) + O2 → CH3 C(O)CH3 + H2 O2
Ценным побочным продуктом этой реакции является ацетон.
В лабораторных условиях для получения пероксида водорода используют реакцию:
BaO2 + H2 SO4 → H2 O2 + BaSO4
Концентрирование и очистку пероксида водорода проводят осторожной перегонкой.
Благодаря своим сильным окислительным свойствам пероксид водорода нашёл широкое применение в быту и в промышленности, где используется, например, как отбеливатель на текстильном производстве и при изготовлении бумаги. Применяется как ракетное топливо — в качестве окислителя или как однокомпонентное (с разложением на катализаторе). Используется в аналитической химии, в медицине, в качестве пенообразователя при производстве пористых материалов, в производстве дезинфицирующих и отбеливающих средств. В промышленности пероксид водорода также находит свое применение в качестве катализатора, гидрирующего агента, как эпоксидирующий агент при эпоксидировании олефинов. В медицине растворы пероксида водорода применяются как антисептическое средство. При контакте с поврежденной кожей и слизистыми пероксид водорода под влиянием фермента каталазы распадается с выделением кислорода, что способствует сворачиванию крови и создает неблагоприятные условия для развития микроорганизмов. Однако такое действие непродолжительно и обладает слабым эффектом. Тем не менее, пероксид водорода (аптечное название — перекись водорода, 3 %) применяется при первичной обработке ран (в том числе открытых). Перекись водорода очень эффективна для лечения небольших царапин, особенно у детей — она не «щиплет», не имеет запаха, бесцветна. Однако она может вызывать небольшое жжение в районе открытой раны. Стоимость пузырька такого раствора (на 2010 год) — около 10 руб. В пищевой промышленности растворы пероксида водорода применяются для дезинфекции технологических поверхностей оборудования, непосредственно соприкасающихся с продукцией. Кроме того, на предприятиях по производству молочной продукции, соков, растворы перекиси водорода используются для дезинфекции упаковки (технология «Тетра Пак»). Для технических целей пероксид водорода применяют в производстве электронной техники.
Перекись водорода применяется также для обесцвечивания волос[1] и отбеливания зубов[2] , однако эффект в обоих случаях основан на окислении, а следовательно, разрушении тканей, и потому такое применение (особенно в отношении зубов) не рекомендуется специалистами.
Формы выпуска
Выпускается в виде водных растворов, стандартная концентрация 1-6 %, 30, 38, 50, 60, 85, 90 и 98 %. 30 % водный раствор пероксида водорода, стабилизированный добавлением фосфатов натрия, называется пергидролем .
См.также: Гидроперит
Опасность применения
Несмотря на то, что пероксид водорода не токсичен, его концентрированные растворы при попадании на кожу, слизистые оболочки и в дыхательные пути вызывают ожоги. В больших концентрациях недостаточно чистый пероксид водорода может быть взрывоопасен. Опасен при приёме внутрь концентрированных растворов. Вызывает выраженные деструктивные изменения, сходные с действиями щелочей. Летальная доза 30%-го раствора пероксида водорода (пергидроля) — 50—100 мл.
Литература
- Ахметов Н. С. Общая и неорганическая химия. М.: Высшая школа, 2001.
- Карапетьянц М. Х., Дракин С. И. Общая и неорганическая химия. М.: Химия, 1994.
Похожие работы
-
Углеводы Глюкоза - представитель моносахаридов
Цель урока: Расширение, углубление и систематизация на межпредметном уровне знаний об углеводах как о важнейших биоорганических соединениях Учебная задача урока:
-
Окисление алкенов
Санкт-Петербургский Государственный Технологический Институт (Технический Университет) Кафедра органической химии Факультет 4 Курс III Группа 476
-
Вода 3
Вода оксид водорода – наиболее распространённое нашей планеты и важное. Водная оболочка Земли, гидросфера, содержит около 1,5 млрд. км3. В земной коре, литосфере, в связанном состоянии находится 1,4 млрд. км3. В атмосфере – 15 тыс. км3. поверхность Земли, занятая водой, в 2 с половиной раза больше суши.
-
Влияние добавок на устойчивость пероксида водорода в водных растворах
Изучение влияния веществ на процесс разложения пероксида водорода в водных растворах. Воздействие различных химических катализаторов на скорость разложения пероксида водорода. Действие твина-80 на разложение пероксида водорода при различных температурах.
-
Барий. Свойства, получение, распространение
Металлический барий и его распространенность в природе. Получение металлического бария. Электролиз хлорида бария. Термическое разложение гидрида. Химические и физические свойства. Применение. Соединения (общие свойства). Неорганические соединения.
-
Литий
(от греч. lithos — камень) — химический элемент I группы периодической системы Д. И. Менделеева, порядковый номер 3, атомная масса 6,941, относится к щелочным металлам. В природе встречается два стабильных изотопа:
-
Материалы по химии (кислоты, оксиды, основания, водород)
бщая характеристика Физические свойства. -Соляная -соляная Агрегатное состояние-жидкосное (H3PO4 твёрдый). -Йодная -йодная Ц-разный -Фторная -фторная
-
Диаграммы состояния трехкомпонентных систем
Министерство общего и профессионального образования Российской Федерации Уральский Государственный Университет химический факультет кафедра высокомолекулярных соединений.
-
Неметаллы 2
Водород Положение в таблице: в главную подгруппу I группы — подгруппу щелочных металлов, а также в главную подгруппу VII группы — подгруппу галогенов.
-
Синтез Na2O2 (пероксида натрия)
Пероксиды как кислородные соединения, их классификация и методика получения, основные физические и химические свойства. Получение и сферы применения пероксида натрия Na2O2. Исчисление количества реагентов, необходимых для получения 10 г пероксида натрия.