Название: Двойной электрический слой
Вид работы: реферат
Рубрика: Химия
Размер файла: 303.05 Kb
Скачать файл: referat.me-370161.docx
Краткое описание работы: Доклад на тему: Двойной электрический слой На поверхности твердого тела при его контакте с жидкостью самопроизвольно возникает двойной электрический слой (ДЭС) - тонкий поверхностный слой из пространственно разделенных электрических зарядов противоположного знака. Возникновение заряда на границе двух фаз относится к одному из видов поверхностных явлений.
Двойной электрический слой
Доклад на тему:
Двойной электрический слой
На поверхности твердого тела при его контакте с жидкостью самопроизвольно возникает двойной электрический слой (ДЭС) - тонкий поверхностный слой из пространственно разделенных электрических зарядов противоположного знака. Возникновение заряда на границе двух фаз относится к одному из видов поверхностных явлений.
Для изобарно-изотермического процесса в отсутствие физико-химических взаимодействий (dT=0, dp=0, dni =0) из уравнения (3.1) получим:
dG£sdB + jdq (1)
В условиях равновесия, когда dG=0,
sdB + jdq = 0, (2)
из уравнения (7.2) несложными преобразованиями можно выразить удельный заряд поверхности qB :
qB = -(d s/d j)T, p, n. (3)
Заряд поверхности, который возникает самопроизвольно, вызван стремлением к уменьшению поверхностного натяжения.
Возникновение ДЭС на границе раздела характерно для золей и суспензий, дисперсная фаза которых формируется из твердых частиц.
1. Существуют два пути образования ДЭС : 1) избирательная адсорбция поверхностью твердой частицы ионов из дисперсионной среды (электролита), 2) ионизация поверхностных молекул твердой частицы.
Поверхность твердого тела адсорбирует ионы определенного знака. Эти ионы называются потенциалопределяющими . К ним из раствора притягиваются ионы противоположного знака – противоионы . Возникает двойной электрический слой.
При смешивании солей нитрата серебра и хлорида калия должен выпадать осадок хлорида серебра по уравнению:
AgNO3 + KCl = AgCl¯ + KNO3
Однако в присутствии избытка хлорида калия осадка не наблюдается, т.к. в растворе образуются коллоиды, имеющие следующее строение:
[n AgCl×m Cl- ×(m-x )K+ ]x- ×x K+ .
При этомCl- - потенциал определяющие ионы, K+ - противоионы.
При избытке нитрата серебра образуются коллоидные частицы состава:
[n AgCl×m Ag+ ×(m-x )NO3 - ]+ × ×x NO3 - .
На поверхности твердой фазы AgCl адсорбируются ионы, находящиеся в избытке, из тех которые могут достраивать кристаллическую решетку (Ag+ или Cl- ). Твердая фаза образует ядро коллоидной частицы . Коллоидная частица имеет заряд адсорбированных потенциал определяющих ионов, частично скомпенсированный противоионами. Вокруг коллоидной частицы в диффузном слое находятся противоионы, заряд которых равен заряду коллоидной частицы. Коллоидная частица и диффузный слой образуют электронейтральную мицеллу (рис.1).
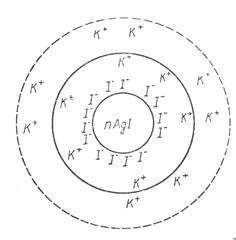
Рис.1. Строение коллоидных мицелл.
Потенциалопределяющими ионами, в зависимости от рН среды, могут так же быть ионы Н+ и ОН- .
Второй путь образования ДЭС - ионизация поверхностных молекул твердых фазы, наблюдается при образовании гидрозолей металлов, например переход ионов серебра в раствор:
[n Ag×m Ag+ ×(m-x )NO3 - ]x+ ×x NO3 - .
Другим примером может быть образование золя серы:
[n S×m HS- ×(m-x )H+ ]x- ×x H+ .
2. ДЭС принято рассматривать как своеобразный конденсатор , внутренняя обкладка которого с потенциалом j формируется из потенциалопределяющих ионов (1), а внешняя из противоионов (2).
Существует несколько теорий образования ДЭС. Простейшая из них – модель плоского конденсатора Гельмгольца, согласно которой потенциалобразующий слой и слой противоионов расположены на молекулярном расстоянии друг от друга. Взаимодействие между слоями осуществляется только за счет электростатических сил, а падение потенциала между слоями происходит линейно (рис.2 а).
В теории Гуи и Чепмена учитывается тепловое движение и взаимное отталкивание противоионов, которые рассматриваются как точечные заряды, не имеющие собственных размеров, расположенные в диффузном слое. Потенциал экспоненциально снижается по мере удаления от поверхности (рис 10б).
Согласно теории Штерна (рис 2в) часть противоионов находится в плотном слое Гельмгольца, другая - в диффузном слое. В плотной части двойного слоя ионы удерживаются за счет электростатических сил и сил специфической адсорбции (некулоновскими силами). Диффузное строение двойного электрического слоя возникает в результате как теплового движения ионов и молекул растворителя, так и в результате взаимного отталкивания одноименных ионов. Таким образом, слой потенциалопределяющих ионов не полностью скомпенсирован в плотном слое. В отличие от противоионов плотного слоя, ионы диффузионного слоя не закреплены и способны перемещаться в пределах диффузионного слоя, который в свою очередь состоит из внутреннего и внешнего слоев.

Рис.2 . Модели строение ДЭС: а – Гельмгольца;, б – Гуи и Чепмена; в – Штерна: 1 – потенциалобразующий слой ионов ; 2, 3 – противоионы в адсорбционном и диффузном слое ; δ – толщина адсорбционного слоя .
Толщина плотной части ДЭС определяется размерами противоинов и зависит от концентрации электролита (С).
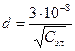 см (4)
см (4)
Потенциал ДЭС (j) снижается по мере удаления от поверхности твердого тела. В плотном слое – линейно. В диффузном слое снижение потенциала происходит экспоненциально.
3. ДЭС на поверхности коллоидной частицы, следуя ее форме, как правило, сферический. Относительное перемещение заряженных частиц и жидкости происходит не по границе твердого тела с жидкостью, а за пределами этой границы по плоскости скольжения, которая проходит по диффузионной части двойного слоя. При движении частиц дисперсной фазы часть жидкости, на поверхности твердой частицы до границы скольжения, перемещается вместе с твердой частицей. Эта часть жидкости на поверхности твердой фазы является неподвижной.
Потенциал на границе скольжения, расположенной в диффузном слое, называют электрокинетическим, или дзета-потенциалом (z). Этот потенциал является важной характеристикой ДЭС, он определяет возможность и скорость относительного перемещения дисперсной фазы и дисперсионной среды, интенсивность электрокинетических явлений, устойчивость золей и разрушение дисперсных систем электролитами. Значение z-потенциала можно определить по скорости движения коллоидных частиц и по скорости движения жидкости. Знак z-потенциала определяется знаком заряда потенциалобразующего слоя.
По скорости движения коллоидных частиц:
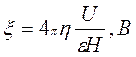 (5)
(5)
где ή - вязкость, ε - диэлектрическая проницаемость, U – скорость электрофоретического переноса (на основании измерений), Н – градиент потенциала внешнего поля, равный Е/L (Е-разность электродных потенциалов, L-расстояние между электродами).
По скорости движения жидкости:
![]() В, (6)
В, (6)
где λ – удельная электрическая проводимость золя, ύ – объемная скорость (объем жидкости, перенесенный через пористую мембрану за единицу времени), I-сила тока, при которой проводится осмос.
Изменение z-потенциала зависит от свойств среды и наличия в ней противоионов. Увеличение их концентрации приводит к сжатию диффузного слоя и снижению z-потенциала. Когда все противоионы будут находиться в адсорбционном слое, происходит полная компенсация потенциалобразующего слоя, z-потенциала становится равным нулю, это изоэлектрическая точка (z=0).
Добавление многовалентных катионов, например Fe3+ , может привести к адсорбции противоионов в сверх эквивалентных количествах. В этих условиях произойдет перезарядка поверхности и изменение знака z-потенциала (рис.3).
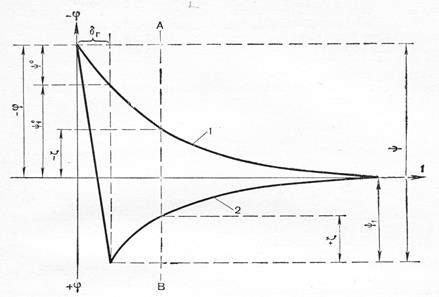
Рис. 3 . Изменение потенциала ДЭС при перезарядке золя: 1- падение потенциала до перезарядки; 2- то же после перезарядки; значения потенциалов до: ψ0 -, ψ1 0 -, -ζ ; после перезарядки: ψ, ψ1 , +ζ.
Похожие работы
-
Методика гравиметрического определения меди
Теоретическая часть: Электролиз - один из простейших и распространённых физико-химических методов анализа. Этот метод основан на выделении из исследуемого раствора электролитическим путем металлов или их окислов. В некоторых случаях метод электролиза рассматривают как вариант гравиметрического метода анализа, в котором реагентом является электрический ток.
-
Коллоидная химия и поверхностные явления
Министерство образования и науки РФ Государственное образовательное учреждение Высшего профессионального образования Воронежский государственный университет
-
Круговорот углерода в природе
Круговорот углерода в природе. Основным резервуаром углерода являются горные породы; в них, по существующим оценкам, его содержится примерно 75 квадриллионов тонн. Еще 5 триллионов тонн содержится в горючих полезных ископаемых — угле, нефти, газе и торфе. Примерно 150 млрд. т приходится на верхний слой донных океанических осадков.
-
Электрокинетические явления в дисперсных системах
Двойной электрический слой - механизмы образования и строение. Теории: Гельмгольца, Гуи, Штерна. Электрокинетический потенциал. Электроосмос. Электрофорез. Потенциал течения и седиментации. Практическое использование электрокинетических явлений.
-
Аэрозоли и порошки
Классификация аэрозолей. Электрические и оптические свойства аэрозолей в различных средах. Уравнение перевода частиц в аэрозольное состояние, методы разрушения аэрозолей. Определение порошков, их свойства и классификация. Коагезия, адгезия, аутогезия.
-
Альфа-метилстирол
Физические свойства. Строение молекул, анализ распределения электронной плотности, анализ реакционной способности. Химические свойства. Реакции полимеризации, полимеры. Получение.
-
Химия (Шпаргалка)
Метан C2 H6 Этан C3 H8 Пропан C4 H10 Бутан C5 H12 Пентан C6 H14 Гексан C7 H16 Гептан C8 H18 Октан C9 H20 Нонан C10 H22 Декан 1.Все атомы, образ. молекулы орган. вещ-в, связаны в опред. послед. согласно их валентностям.
-
Коррозия металла
Введение Коррозия стали и цветных металлов принципиально отличается от коррозионных процессов в неметаллических строительных материалах. Большинство так называемых драгоценных металлов, особенно сталь, в большей степени подвержены коррозии, чем неметаллические материалы. Средняя скорость коррозии основных металлов в условиях средне европейского климата представлена в табл. 2.1 Из таблицы видно, что наибольшие потери наблюдаются для обычных сталей.
-
Бутадиеновый каучук
Доклад по химии. БУТАДИЕНОВЫЙ КАУЧУК 11 «А» класс Осипов Сергей. Домодедово 1997г. Знаете ли вы, что ... У островов Гаити во время своего путешествия (1493) испанский адмирал Христофор Колумб увидел туземцев, игравшим большим плотным мячом. Хотя это казалось невероятным, но, ударяясь о землю, мяч довольно высоко подскакивал в воздух.
-
Процессы адгезии и когезии
Понятие и работа процессов когезии и адгезии, смачивание и растекание. Краевой угол смачивания, гидрофобные и гидрофильные поверхности. Эффект Марангони и адсорбция ионов на кристалле. Электрокинетические явления и потенциал. Правила составления мицелл.