Название: Алюминий металл будущего
Вид работы: реферат
Рубрика: Химия
Размер файла: 433.78 Kb
Скачать файл: referat.me-370368.pptx
Краткое описание работы: Алюминий – металл будущего «Серебро из глины» - Немецкий учёный Ф. Велер (1827 г.) получил алюминий при нагревании хлорида алюминия со щелочными металлами калий и натрий.
Алюминий металл будущего
Алюминий –
металл будущего
«Серебро из глины»
- Немецкий учёный Ф. Велер (1827 г.)
получил алюминий при нагревании
хлорида алюминия со щелочными
металлами калий и натрий.
Из истории открытия
В период открытия алюминия - металл был дороже золота. Англичане хотели почтить богатым подарком великого русского химика Д.И Менделеева, подарили ему химические весы, в которых одна чашка была изготовлена из золота, другая - из алюминия. Чашка из алюминия стала дороже золотой. Полученное «серебро из глины» заинтересовало не только учёных, но и промышленников и даже императора Франции.
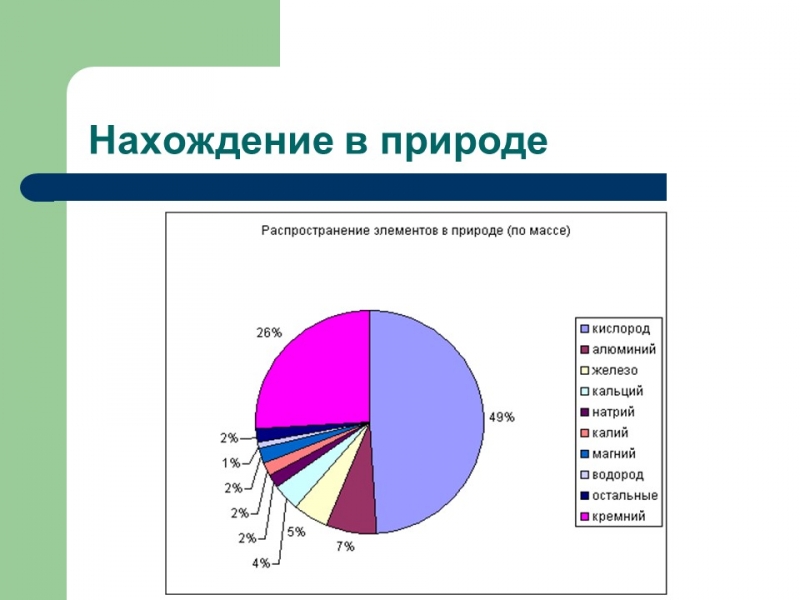
Нахождение в природе
Физические свойства
- Алюминий – металл серебристо- белого цвета, лёгкий ( q- 2,7 г./ см.3 ), плавится при температуре 6600 С. обладает хорошей ковкостью, пластичностью, электрической проводимостью и теплопроводностью, легко поддаётся обработке, образует лёгкие и прочные сплавы.
Химические свойства
- Алюминий восстанавливает все элементы, находящиеся справа от него в электрохимическом ряду напряжения металлов, простые вещества – неметаллы. Из сложных соединений алюминий восстанавливает ионы водорода и ионы менее активных металлов. Однако при комнатной температуре на воздухе алюминий не изменяется, поскольку его поверхность покрыта защитной оксидной плёнкой.
Применение алюминия
Металл будущего
- Обладая такими свойствами как лёгкость, прочность, коррозионноустойчивость, устойчивость к действию сильных химических реагентов - алюминий нашёл большое занимают в авиационном и космическом транспорте применение во многих отраслях народного хозяйства. Особое место алюминий и его сплавы, электротехнике, а за ними будущее нашей науки и техники.
Аллотропные Модификации
- Белый фосфор – P4 запах чесночный, Н в воде, Р в органических растворителях, летуч, Tпл = 440 С, молекулярная кристаллическая решётка, активен, на воздухе окисляется, в темноте светится, ЯДОВИТ!!!
Аллотропные Модификации
- Красный фосфор – цвет красно-бурый, не ядовит, Не растворим в воде и органических растворителях, атомная кристаллическая решётка, устойчив .
Аллотропные Модификации
- черный фосфор – без запаха, похож на графит, жирный на ощупь, Не растворим в воде и органических растворителях, атомная кристаллическая решетка, полупроводник , Ткип = 453°С (возгонка), Тпл = 1000°С (при р=1,8 • 109 Па), устойчив .
5С + 3SiO2 + Са3 (РО4 )2 = 5СО + 3CaSi03 + 2Р (сплавление в электрической печи)
- Взаимодействие с кислородом.
- 4Р°+502
=t
2Р+
5
2
O5
белый Т = 40°С красный Т = 260°С черный Т = 400°С
- 4Р°+ ЗО2 = 2Р+ 3 2 O3
(недостаток О2 )
2. Взаимодействие с галогенами.
- 2Р°+ЗСl2 = 2Р+3 С13
легко разлагается водой
- РС13 + ЗН2 О = Н3 РО3 + ЗНС1
3. Взаимодействие с азотной кислотой.
- ЗР°+ 5HNO3 + 2Н2 О = ЗН3 Р+ 5 O4 + 5NO
















Похожие работы
-
Композиционные материалы алюминий
Около 100 лет назад Николай Гаврилович Чернышевский, сказал об алюминии, что этому металлу суждено великое будущее, что алюминий – металл социализма. Он оказался провидцем: в XX в. элемент №13 алюминий стал основой многих конструкционных материалов. Элемент 3-го периода и IIIА-группы Периодической системы.
-
Аллюминий 2
Содержание 1. Общие сведения 1 стр. 2. Получение алюминия 1 стр. 3. Особенности и свойства алюминия 2 стр. 4. Применение алюминия 4 стр. 5. Оксид, гидроксид, хлорид и сульфат алюминия 4 стр.
-
Платина 3
Цветная металлургия Области применения цветных металлов быстро расширяются, особенно в новейших отраслях машиностроения: в начале XX в. получали всего лишь 15 видов цветных металлов, а в настоящее время — более 70.
-
Титан
Общая характеристика титана как химического элемента IV группы периодической системы Д.И. Менделеева. Химические и физические свойства титана. История открытия титана У. Грегором в 1791 году. Основные свойства титана и его применение в промышленности.
-
Периодическая система химических элементов Д.И. Менделеева
периоды VIII 1,0079 Водород 4,0026 Гелий 6,939 Литий 9,0122 Бериллий 10,811 12,01115 Углерод 14,0067 Азот 15,9994 Кислород 18,9984 Фтор 20,179 Неон 22,9898
-
Щелочные металлы
Щелочные металлы- химические элементы главной подгруппы 1 группы периодической системы элементов Д. И. Менделеева: Li - литий, Na - натрий, K - калий, Rb - рубидий , Сs- цезий, Fr - франций. Получили свое название от гидроокисей щелочных металлов, названные едкими щелочами. Атомы щелочных металлов имеют на внешней оболочке по 1 s - электрону, а на предшествующей - 2 s и 6 р- электронов ( кроме лития).
-
Натрий 2
НАТРИЙ История и происхождения названия На́трий — элемент главной подгруппы первой группы, третьего периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 11. Обозначается символом Na (лат. Natrium). Простое вещество натрий (CAS-номер: 7440-23-5) — мягкий щелочной металл серебристо-белого цвета.
-
Свойства алюминия и области применения в промышленности и быту
История получения алюминия. Классификация алюминия по степени чистоты и его механические свойства. Основные легирующие элементы в алюминиевых сплавах и их функции. Применение алюминия и его сплавов в промышленности и быту. Алюминий как материал будущего.
-
Алюминий и его свойства
История получения алюминия, его физические и химические свойства, химический состав, нахождение в природе и производство. Применение в качестве восстановителя, в ювелирных изделиях, стекловарении. Сплавы на основе алюминия, алюминий как добавка в сплавы.
-
Алюминий
Общая характеристика алюминия. Алюминий - типичный металл, кристаллическая решетка кубическая гранецентрированная. Название и история открытия. Нахождение в природе, получение. Промышленное получение. Применение. Биологоческая роль.