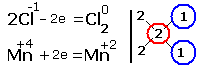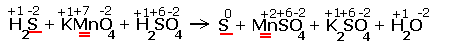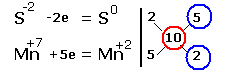Название: Составление уравнений окислительно-восстановительных реакций
Вид работы: реферат
Рубрика: Биология
Размер файла: 26.1 Kb
Скачать файл: referat.me-20463.docx
Краткое описание работы: Составление уравнений окислительно-восстановительных реакций. Существуют два метода составления окислительно - восстановительных реакций - метод электронного баланса и метод полуреакций. Здесь мы рассмотрим метод электронного баланса.
Составление уравнений окислительно-восстановительных реакций
Составление уравнений окислительно-восстановительных реакций.
Существуют два метода составления окислительно - восстановительных реакций - метод электронного баланса и метод полуреакций. Здесь мы рассмотрим метод электронного баланса.
В этом методе сравнивают степени окисления атомов в исходных веществах и в продуктах реакции, приэтом руководствуемся правилом: число электронов, отданных восстановителем, должно равняться числу электронов, присоединённых окислителем.
Для составления уравнения надо знать формулы реагирующих веществ и продуктов реакции. Рассмотрим этот метод на примере.
| Расставить коэффициенты в реакции, схема которой: HCl + MnO2 |
| Алгоритм расстановки коэффициентов |
| 1.Указываем степени окисления химических элементов.
Подчёркнуты химические элементы, в которых изменились степени окисления. |
| 2.Составляем электронные уравнения, в которых указываем число отданных и принятых электронов.
За вертикальной чертой ставим число электронов, перешедших при окислительном и восстановительном процессах. Находим наименьшее общее кратное ( взято в красный кружок). Делим это число на число перемещённых электронов и получаем коэффициенты (взяты в синий кружок). Значит перед марганцем будет стоять коэффициент-1, который мы не пишем, и перед Cl2 тоже -1. Перед HCl коэффициент 2 не ставим, а считаем число атомов хлора в продуктах реакции. Оно равно - 4.Следовательно и перед HCl ставим - 4,уравниваем число атомов водорода и кислорода справа, поставив перед H2O коэффициент - 2. В результате получится химическое уравнение:
|
| Рассмотрим более сложное уравнение: |
| H2S + KMnO4 + H2SO4 |
| Расставляем степени окисления химических элементов:
|
| Электронные уравнения примут следующий вид
Перед серой со степенями окисления -2 и 0 ставим коэффициент 5, перед соединениями марганца -2, уравниваем число атомов других химических элементов и получаем окончательное уравнение реакции |
|
|
Похожие работы
-
Шифр КФ Классификация ферментов
Шифр КФ (Классификация ферментов) или код фермента — это классификационный номер фермента по международной иерархической классификации. Принятая система классифицирует ферменты по группам и индексирует индивидуальные ферменты, что важно для стандартизации исследований.
-
Основы биохимии
Характеристика основных видов рибонуклеиновых кислот. Биологическое значение фосфатидов. Энергетический эффекты гликолиза. Описание аэробной и анаэробной работоспособности человека. Биохимические основы быстроты как качества двигательной деятельности.
-
Кинетика действия ферментов
Кинетические исследования ферментативных реакций для определения ферментов и сравнения их скоростей. Образование из фермента и субстрата фермент-субстратного комплекса за счет сил физической природы. Факультативные организмы, автотрофы и гетеротрофы.
-
Обеспечение организма витаминами
Физиологическое значение витаминов, их классификация, пути поступления в организм человека. Ассимиляция и диссимиляция витаминов, их способность регулировать течение химических реакций в организме. Особенности жирорастворимых и водорастворимых витаминов.
-
Обмен веществ и энергии в живых организмах
Пермская Государственная Медицинская Академия Кафедра биологической химии Обмен веществ и энергии в живых организмах. Выполнила: студентка
-
Витамины. Витамин C (аскорбиновая кислота)
Витамины. Витамин (аскорбиновая кислота). Работа ученика 10 «А» класса Максишко Данилы Витамины (от латинского слова vita- жизнь) - группа органических соединений разнообразной химической природы, необходимых для питания человека, животных и других организмов в ничтожных количествах по сравнению с основными питательными веществами (белками, жирами, углеводами и солями), но имеющих огромное значение для нормального обмена веществ и жизнедеятельности.
-
Растениеводство 2
Растениеводство — наука о культурных растениях и их возделывании. Рассматривать растениеводство с производственной точки зрения, учение рентабельном выращивании максимальных урожаев продукции с-х. культур. при высоком ее качестве. Научное растениеводство строится на принципах современной биологической науки, изучающей особенности развития растений, их требования к условиям среды.
-
Аффинность антител и кинетика реакций
Методы определения аффинности антител. Способы расчета констант комплексообразования реакции антиген—антитело, ее кинетические закономерности. Сущность метода равновесного диализа. Экспериментальные методы и определения кинетических констант реакции.
-
Особенности физиологии и биохимии микроорганизмов
Самостоятельная работа по микробиологии № 5 на тему «Особенности физиологии и биохимии микроорганизмов. Ферменты и их роль в метаболизме микробной клетки.
-
Научные открытия в области фотосинтеза, сделанные в XX в.
Изучение фотосинтеза с момента его открытия Д. Пристли. Краткая хронология открытий ХХ в. в области фотосинтеза. Идея Тимирязева о непосредственном участии хлорофилла в акте фотосинтеза, обратимые окислительно-восстановительные превращения пигмента.