Название: Фенолы. Реакции нуклеофильного замещения ароматических соединений. Получение фенолов
Вид работы: реферат
Рубрика: Химия
Размер файла: 102.94 Kb
Скачать файл: referat.me-368302.docx
Краткое описание работы: Понятие фенолов, их сущность и особенности, общая формула, характеристика и химические свойства. Распространенность в природе производных фенолов и их использование в медицине и парфюмерии. Реакции нуклеофильного замещения ароматических соединений.
Фенолы. Реакции нуклеофильного замещения ароматических соединений. Получение фенолов
Введение
Фенолами называют соединения общей формулы Ar-OH. Они отличаются от спиртов тем, что в них гидроксильная группа непосредственно присоединена к ароматическому кольцу. В зависимости от количества гидроксильных групп фенолы различаются по атомности: одноатомные, двухатомные, трехатомные и т.д., для бензола до шестиатомных. Для метилфенолов принято специальное название - крезолы.



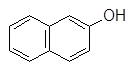
Фенол 4-Метилфенол (п-крезол) a-Нафтол b-Нафтол
Производные фенолов широко распространены в природе. Тимол является антисептиком и используется в парфюмерии. Эвгенол содержится в различных эфирных маслах, в том числе в гвоздичном масле.
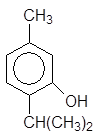
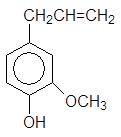
2-Изопропил-5-метилфенол 4-Аллил-2-метоксифенол
(тимол) (эвгенол)
Ароматическое ядро, непосредственно связанное с гидроксильной группой оказывает сильное влияние на ее поведение. Это влияние так велико, что фенолы и спирты представляют собой разные классы органических соединений. Они отличаются, прежде всего, по кислотности. Значения рКа большинства спиртов составляет около 18, в то время как фенолов - менее 11. Сравним, например, циклогексанол и фенол:

Циклогексанол Фенол
рКа = 18 рКа = 9.9
Фенолы являются более сильными кислотами, чем вода, в то время как спирты более слабыми, чем вода. В отличие от спиртов фенолы со щелочью дают соли – феноксиды (феноляты), не разрушающиеся водой, но разлагающиеся более сильной угольной кислотой.
![]()
![]()
Приведенные реакции используются для разделения фенолов, спиртов и карбоновых кислот. Фенолы, содержащие электроноакцепторные группы в ядре, имеют большую кислотность, чем сам фенол. Большая кислотность фенолов по сравнению со спиртами может быть объяснена тем, что электронная плотность в них с атома кислорода смещена на бензольное кольцо.
1. Реакции нуклеофильного замещения ароматических соединений
Нитрогруппа обладает сильно выраженным электроноакцепторным характером и оказывает значительное влияние на атомы и группы, находящиеся по отношению к ней в о- и п-положениях. Так, при нагревании нитробензола с порошкообразным КОН получается смесь о- и п-нитрофенолов:
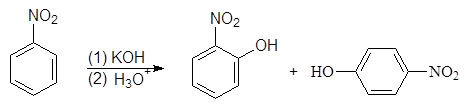 (7)
(7)
о-Нитрофенол п-Нитрофенол
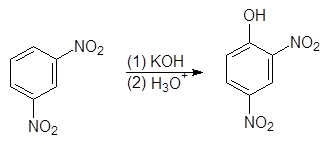 (8)
(8)
2,4-Динитрофенол
Реакция проходит по механизму нуклеофильного замещения:
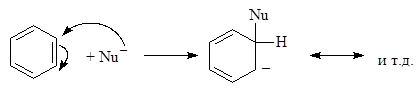 (М 2)
(М 2)
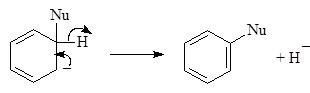
Замещаемый водород должен покидать молекулу с парой электронов, т.е. уходить в виде гидрид-аниона. Гидрид-анион окисляется избытком нитробензола:
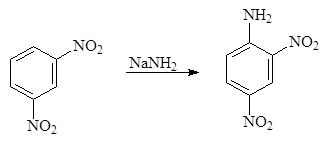 (9)
(9)
2,4-Динитроанилин
Хорошим нуклеофильным реагентом является гидроксиламин. При его использовании применять специальные меры для удаления гидроксид-аниона не требуется. Из тринитробензола в водноспиртовом растворе по этой реакции получается 2,4,6-тринитроанилин или пикрамид:
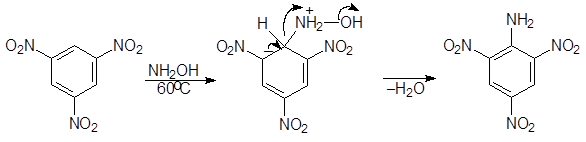 (10)
(10)
Пикрамид
а из a-нитронафталина _ 4-нитро-1-аминонафталин:
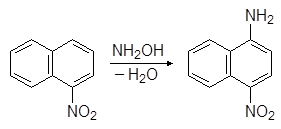 (11)
(11)
К реакциям нуклеофильного замещения атома водорода в ароматическом кольце относится синтез салициловой кислоты из бензойной под действием пероксида водорода.
 (12)
(12)
Бензойная кислота Салициловая кислота
Из реакций нуклеофильного замещения электроноакцепторных групп в аренах, не содержащих активирующих групп, наибольшее значение имеют реакции замещения сульфогруппы. Сплавлением щелочных солей сульфокислот с твердыми щелочами и цианидами натрия и калия получают, соответственно, фенолы и арилцианиды.
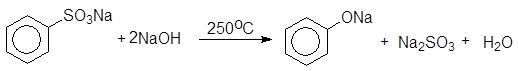 (13)
(13)
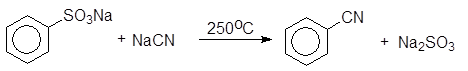 (14)
(14)
Бензонитрил
2. Способы получения фенолов
Фенол - один из важнейших продуктов промышленной органической химии; он используется в качестве сырья в синтезе ряда важнейших продуктов, начиная с аспирина и кончая важнейшими пластиками. Мировое производство фенола превышает 3 миллиона тонн в год. Некоторое количество фенола и крезолов выделяют из легкого масла каменноугольной смолы. Используется несколько промышленных методов получения фенола.
2.1 Кумольный метод (Сергеева)
Большую часть фенола в настоящее время производят из изопропилбензола – кумола. Окислением кумола воздухом получают гидроперекись кумола, разлагающуюся под действием водных растворов минеральных кислот на фенол и ацетон. Кумол синтезируют из бензола и пропилена.
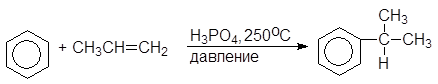 (15)
(15)
Кумол
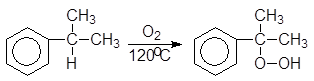 (16)
(16)
Гидроперекись кумола
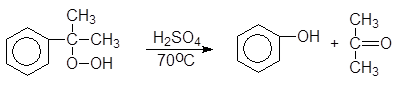 (17)
(17)
Механизм:
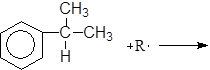
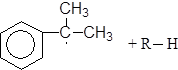
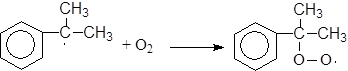 (М 3)
(М 3)
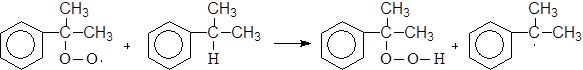
и т.д.
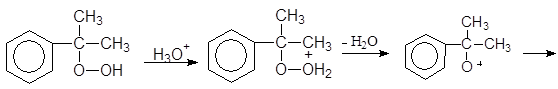 (М 4)
(М 4)
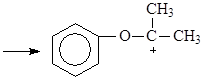
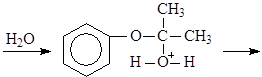
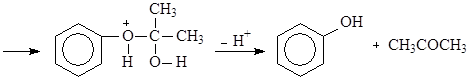
Аналогично ведет себя гидроперекись втор-бутила.
2.2 Гидролиз арилгалогенидов
Хлор в хлорбензоле малоподвижен и поэтому гидролиз ведут 8%-ным раствором NaOH в автоклаве при 250оС в присутствии солей меди:
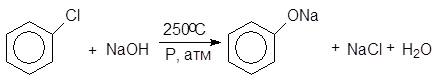 (18)
(18)
Феноксид натрия
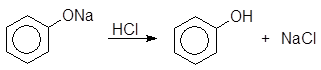 (19)
(19)
По методу Рашига хлорбензол получают окислением бензола в присутствии хлороводорода:
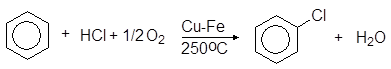 (20)
(20)
Гидролиз хлорбензола осуществляют перегретым паром в присутствии медного катализатора. Образующийся при этом хлороводород возвращают на первую стадию процесса:
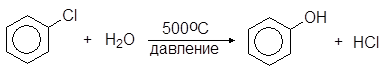 (21)
(21)
Гидролиз в присутствии щелочи проходит при более низкой температуре, но при этом теряется ценная соляная кислота, сохраняющаяся в методе Рашига.
2.3 Сплавление арилсульфонатов со щелочью
При сплавлении со щелочью арилсульфонаты претерпевают реакцию замещения:
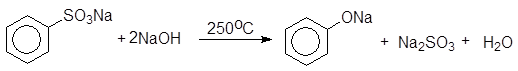 (13)
(13)
Бензолсульфокислота Бензолсульфонат натрия
Превращение фенолята натрия в фенол осуществляется с помощью диоксида серы, который образуется на второй стадии:
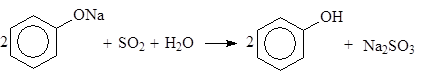 (20)
(20)
Фенол получают в виде водного раствора, из которого его выделяют дистилляцией. Этот метод синтеза фенола является самым старым (1890 г.). Метод используется для получения и других фенолов, например:
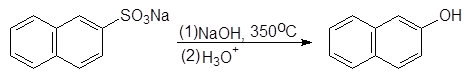 (21)
(21)
β-Нафтол
Похожие работы
-
Фенолы и нафтолы
Лекция 10. Фенолы и нафтолы Фенолы – органические соединения, содержащие в молекулах гидроксильную группу, связанную непосредственно с бензольным кольцом.
-
Ненасыщенные спирты Фенолы Хиноны
Ненасыщенные спирты.Фенолы. Хиноны. К ненасыщенным относятся спирты с двойной углерод-углеродной связью (1,2); с тройной углерод-углеродной связью (3); фенолы (4).
-
Ненасыщенные альдегиды и кетоны
Ненасыщенные альдегиды и кетоны Ненасыщенные альдегиды и кетоны, в зависимости от взаимного расположения двойной и карбонильной групп в молекуле, могут быть поделены на три группы: с сопряженными (CH=CH
-
Химические свойства ароматических углеводородов. Полиядерные ароматические соединения
Химические свойства: реакции электрофильного замещения, присоединения, гидрирование и галогенирования. Алкилирование по Фриделю-Крафтсу. Правила ориентации в бензольном кольце. Влияние заместителей в ядре на и распределение изомеров при нитровании.
-
Сложные эфиры (эстеры)
Классификация, свойства, распространение в природе, основной способ получения эфиров карбоновых кислот путем алкилирования их солей алкилгалогенидами. Реакции этерификации и переэтерификация. Получение, восстановление и гидролиз сложных эфиров (эстеров).
-
Ароматические гетероциклические соединения
Понятие и сущность соединений. Описание и характеристика ароматических гетероциклических соединений. Получение и образование соединений. Реакции по атомному азоту, электрофильного замечания и нуклеинового замещения. Окисление и восстановление. Хинолин.
-
Арилгалогениды и фенолы
Характеристика фенолов, их виды и использование, отличия фенолов от спиртов. Характеристика реакций арилгалогенидов, использование их в промышленности. Нуклеофильное замещение по механизмам отщепление-присоединение и присоединение-отщепление, их стадии.
-
Нуклеофильное замещение у тетраэдрического атома углерода
Примеры нуклеофильных реакций. Мономолекулярное нуклеофильное замещение и отщепление. Стереохимическое течение реакций нуклеофильного замещения. SN1 и SN2 реакции. Влияние факторов на реакции замещения. Применение реакций нуклеофильного замещения.
-
Реакции фенолов
Фенолы, реакции по гидроксильной группе. Замещение в кольцо. Нитрование. Сульфирование. Галогенирование. Реакция Кольбе. Конденсация с карбонилсожержащими соединениями. Перегруппировка Кляйзена. Аллилвиниловый эфир 4-Пентеналь. Перициклические реакции.
-
Функциональные замещенные алициклических и ароматических соединений
Понятие галогенпроизводных углеводородов, их изомерия и номенклатура, общая формула и метод составления названий. Методы получения галогенпроизводных углеводородов, их применение в промышленности. Характер действия хлора на углеродосодержащие вещества.