Название: Ароматические гетероциклические соединения
Вид работы: учебное пособие
Рубрика: Химия
Размер файла: 175.51 Kb
Скачать файл: referat.me-369366.docx
Краткое описание работы: Понятие и сущность соединений. Описание и характеристика ароматических гетероциклических соединений. Получение и образование соединений. Реакции по атомному азоту, электрофильного замечания и нуклеинового замещения. Окисление и восстановление. Хинолин.
Ароматические гетероциклические соединения
АРОМАТИЧЕСКИЕ ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ
Введение
1. Пиридин
1.1. Получение
1.2. Реакции по атому азота
1.3. Реакции электрофильного замещения
1.4. Реакции нуклеофильного замещения
1.5. Окисление и восстановление
2. Хинолин
Введение
Гетероциклическими называют соединения, содержащие циклы, включающие один или несколько гетероатомов. Наиболее устойчивыми являются пяти- и шестичленные циклы.
Гетероциклические соединения встречаются во многих природных соединениях и производятся в больших масштабах в промышленности. В данной главе мы будем рассматривать главным образом гетероциклические соединения, обладающие ароматическим характером. Такие гетероциклы называют гетероароматическими.
Существуют пятичленные, шестичленные и т.д. гетероциклы, обладающие ароматическим характером. Наиболее изученными из них являются пяти- и шестичленные соединения, поскольку их производные особенно распространены в природе и часто являются промышленными продуктами. В циклы этих соединений могут входить один, два и большее количество гетероатомов, причем как одинаковых, так и разных. Большинство из них имеют традиционные названия.
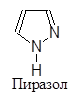
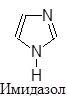
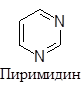
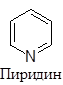
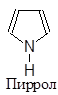
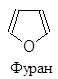 |
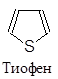 |
Большое значение имеют такие соединения, в которых указанные гетероциклы сконденсированы с другими кольцами.
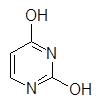
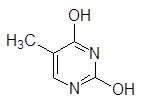
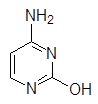
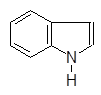

Урацил Тимин Цитозин Индол Хинолин
1. Пиридин
Наиболее важным шестичленным гетероциклическим соединением является пиридин. Cтруктура пиридина во многом сходна со структурой бензола. Длина связи С-С в нем составляет 0,139 нм, а связи С-N - 0,137 нм.
Строение и стабильность пиридина и его ярко выраженный ароматический характер является следствием высокой степени делокализации электронов, пять из которых дают атомы углерода, а шестой - атом азота. Свободная пара электронов на атоме азота находится на s-орбитали, а потому не может участвовать в сопряжении.
Пиридин используется как растворитель и основной катализатор.
Пиридиновое кольцо встречается во многих природных соединениях (никотин, витамин B6 ). Никотин - стимулятор и яд содержится в стеблях и листьях табака.

Никотин Пиридоксин (витамин В6 )
1.1. Получение
Пиридин получают пропусканием смесии ацетилена с циановодородом в молярном соотношении 2:1 через раскаленные трубки.
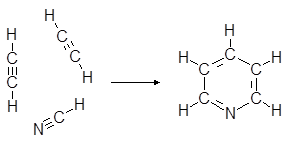 (1)
(1)
1.2. Реакции по атому азота
Пиридин является основанием и в присутствии кислот протонизируется:
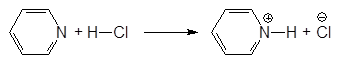 (2)
(2)
Пиридинийхлорид
Пиридин реагирует с оксидом серы (VI) образуя пиридинсульфотриоксид:
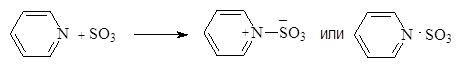 |
(3)
Пиридинсульфотриоксид
Как любой третичный амин пиридин окисляется пероксидом водорода или надкислотами:
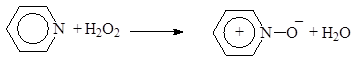 |
(4)
N-Оксипиридин
(N-окись пиридина)
(5)
Этилпиридинийбромид
Упр.1. Напишите реакцию пиридина с (а) соляной кислотой, (б) метилйодидом, (в) перекисью водорода.
Упр.2. Пиридинсульфотриоксид можно получать: (а) пропуская в пиридин пары оксида серы (VI), (б) медлено прибавляя к пиридину хлорсульфоновую кислоту. Напишите соответствующие реакции.
1.3. Реакции электрофильного замещения
Реакции электрофильного замещения с пиридином проходят сложнее, чем с бензолом, так как атом азота дезактивирует ароматическое ядро.
Присутствие основного атома азота в пиридиновом кольце препятствует реакции электрофильного замещения, т. к. катионы Br+ , NO2 + , SO3 OH+ и RCO+ , обычно замещающие атомы водорода в бензольном кольце, фиксируются атомом азота и делают его положительно заряженным, что дезактивирует кольцо.
Возникающий пиридиний - катион чрезвычайно нереакционноспособен по отношению к электрофильным реагентам из-за своего положительного заряда на атоме азота.
При атаке электрофила по a- или c-положению возникает крайне неустойчивый катион в то время как при атаке по b-положению он не особенно неустойчив:
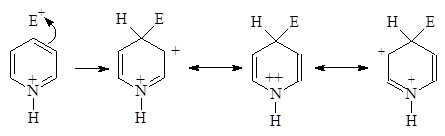 |
Очень неустойчив
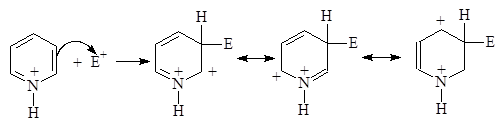
Неустойчив
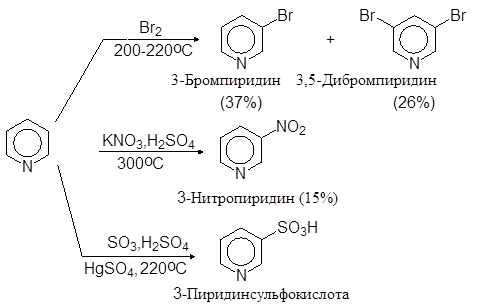 |
(6)
(7)
Упр.3. Напишите реакции (а) нитрования и (б) сульфирования пиридина и опишите их механизм.
1.4. Реакции нуклеофильного замещения
Наибольшее значение для пиридина имеют реакции нуклеофильного замещения. При нагревании пиридина с амидом натрия образуется
2-аминопиридин (реакция Чичибабина):
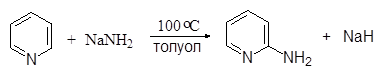 |
(9)
2-Аминопиридин
(a-аминопиридин)
Реакция проходит по следующему механизму:
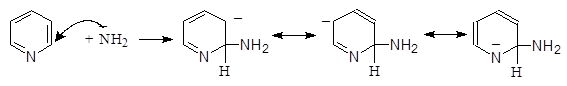 (М 1)
(М 1)
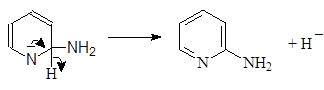
На практике гидрид натрия далее реагирует с a-аминопиридином давая натриевое производное аминопиридина:
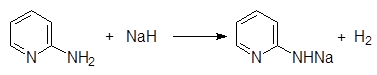 (10)
(10)
Прибавление воды высвобождает a-аминопиридин:
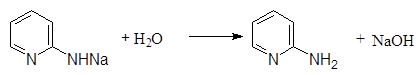 |
(11)
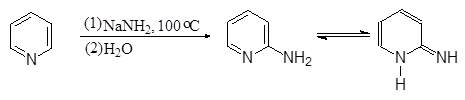 Суммарно:
Суммарно:
(13)
Взаимодействие пиридина со щелочью приводит к образованию 2-гидрокси-пиридина, существующего, как и a-аминопиридин, в двух таутомерных формах:
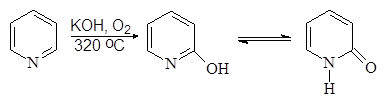 |
(14)
2-Пиридинол 2-Пиридинон
Упр.4. Напишите таутомерные формы a-аминопиридина.
При действии на пиридин литийорганических соединений a-атом водорода замещается на углеводородный радикал:
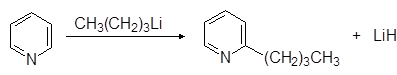 (15)
(15)
a-Бутилпиридин
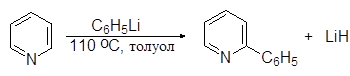 |
(16)
a-Фенилпиридин
Упр.5. Напишите реакции получения (а) 2-аминопиридина,
(б) 2-гидроксипиридина, (в) 2-бутилпиридина, (г) 2-фенилпиридина и опишите их механизм.
1.5. Окисление и восстановление пиридина
Пиридиновое, как и бензольное кольцо устойчиво к окислению. Все три
(a,b и c) пиколина окисляются перманганатом калия в пиридинкарбоновые
(a,b и g-пиколиновые) кислоты:
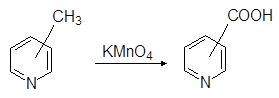 (17)
(17)
Пиколины Пиколиновые кислоты
Никотин может быть окислен в никотиновую кислоту:

(18)
Никотин Никотиновая кислота
Никотиновую кислоту (витамин Р) синтетически получают по следующей схеме:
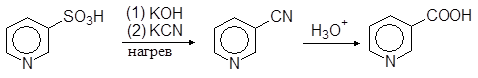 (19)
(19)
b-Пиридинсульфокислота Никотиновая кислота
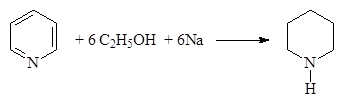 Пиридин восстанавливается легче бензола. Например, натрием в спирте он восстанавливается в пиперидин:
Пиридин восстанавливается легче бензола. Например, натрием в спирте он восстанавливается в пиперидин:
(20)
Пиперидин
Упр.6. Напишите реакции окисления (а) c-пиколина, (б) никотина.
Упр.7. Напишите уравнения реакций взаимодействия пиридина со следующими реагентами: (а) нитратом натрия и серной кислотой (при 370о С);
(б) олеумом (в присутствии HgSO4 при 230о C); (в) амидом натрия, затем водой;
(г) гидроксидом калия в присутствии окислителя; (д) фениллитием;
(е) н-бутиллитием.
2. ХИНОЛИН
Хинолин и его гомологи содержатся в каменноугольной смоле. Существует много синтетических методов получения хинолина. Из них наиболее широко используемым является метод Скраупа. По методу Скраупа хинолин получают нагреванием анилина с глицерином в концентрированной серной кислоте в присутствии мягко действующего окислителя, такого как нитробензол:
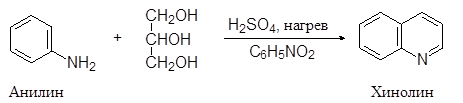
(21)
Реакция проходит по следующему механизму:
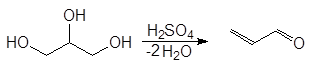 (М 2)
(М 2)
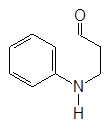 |
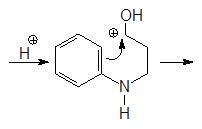 |
||||
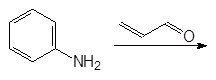 |
|||||
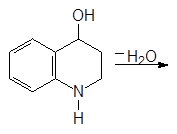 |
|||||
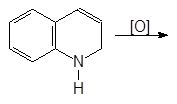 |
 |
||||
По свойствам хинолин очень напоминает пиридин. Он вступает в реакции электрофильного замещения. Эти реакции протекают легче чем в случае пиридина и осуществляются по бензольному кольцу:
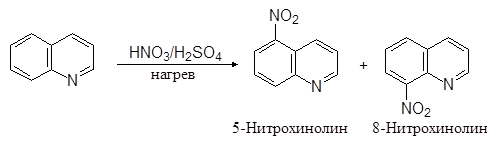 (22)
(22)
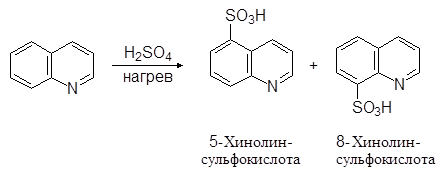 (23)
(23)
Реакции нуклеофильного замещения протекают наоборот по пиридиновому кольцу, причем для образующихся амино- и оксихинолинов возможна таутомерия:
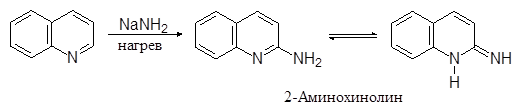 |
(24)
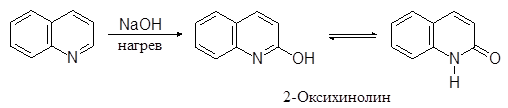
(25)
Упр.8. Напишите реакции нитрования и сульфирования хинолина. В какое кольцо - пиридиновое или бензольное вступает заместитель?
Упр.9. Аналогично пиридину хинолин вступает в реакцию Чичибабина с образованием 2-аминохинолина. Напишите уравнение реакции. По какому механизму идет эта реакция?
Похожие работы
-
Индол. Порфин. Тетраазапорфин. Фталоцианины
Понятие и характеристика таких соединений как: индол, порфин, тетраазапорфин и фталоцианин, их описание и характеристика. Свойства химических соединений и методика их получения. Реакции электрофильного замещения. Восстановление соединений и окисление.
-
Гетероциклические соединения
Понятие гетероциклических соединений, их сущность и особенности, основные химические свойства и общая формула. Классификация гетероциклических соединений, разновидности, отличительные черты и способы получения. Реакции электрофильного замещения.
-
Гетероциклы.Классификация и описание свойств
Гетероциклические соединения Гетероциклическими называются соединения, имеющие в своем составе кольца (циклы), в образовании которых, кроме атомов углерода, принимают участие и атомы других элементов.
-
Нитросоединения
Сущность и понятие нитросоединений. Способы их получения и реакция нитросоединения. Таутомерия алифатических нитросоединений и конденсация их с альдегидами и кетонами. Восстановление и окисление нитросоединений. Реакции получения соединений, их описание.
-
Методы синтеза хинолинов и изохинолинов
Хинолиновая циклическая система веществ. Большинство синтезов, ведущих к образованию хинолиновой циклической системы. Синтез Дебнера-Миллера, Скраупа, Конрада-Лимпаха-Кнорра, Пфитцингера. Щелочное гидролитическое раскрытие пятичленного кольца изатина.
-
Химические свойства ароматических углеводородов. Полиядерные ароматические соединения
Химические свойства: реакции электрофильного замещения, присоединения, гидрирование и галогенирования. Алкилирование по Фриделю-Крафтсу. Правила ориентации в бензольном кольце. Влияние заместителей в ядре на и распределение изомеров при нитровании.
-
Ароматические соединения с конденсированными ядрами
Понятие ароматических соединений с конденсированными ядрами, их сущность и особенности, общая формула, основные химические свойства, реакционность. Изомерия и номенклатура монозещенного нафталина, его структура и строение. Получение и применение нафтолов.
-
Фуран. Тиофен. Пиррол
Понятие и характеристика таких соединений как: фуран, тиофен, пиррол и др., их описание и характеристика. Свойства химических соединений и методика их получения. Кислотно-основные свойства. Реакции электрофильного замещения. Восстановление соединений.
-
Амины
Сущность, понятие и характеристика аминов. Их основные свойства и реакции. Характеристика реакций получения аминов, их восстановления и окисления. Методы получения аминов. Аммонолиз гелоленуглеводородов, описание их основных свойств и реакций соединений.
-
Алифатические нитросоединения
Понятие нитросоединений, их сущность и особенности, основные химические свойства. Классификация нитросоединений, их разновидности и характеристика, отличительные черты и способы получения. Парофильное нитрование, его применение в промышленности.