Название: Характеристика ацетиленовых углеводородов
Вид работы: реферат
Рубрика: Химия
Размер файла: 40.2 Kb
Скачать файл: referat.me-368397.docx
Краткое описание работы: АЦЕТИЛЕНОВЫЕ УГЛЕВОДОРОДЫ (АЛКИНЫ) Ацетиленовыми углеводородами (алкинами) называются непредельные (ненасыщенные) углеводороды, содержащие в молекуле одну тройную связь и имеющие общую формулу CnH2n-2. Родоначальником гомологического ряда этих углеводородов является ацетилен HCCH.
Характеристика ацетиленовых углеводородов
АЦЕТИЛЕНОВЫЕ УГЛЕВОДОРОДЫ
(АЛКИНЫ)
Ацетиленовыми углеводородами (алкинами) называются непредельные (ненасыщенные) углеводороды, содержащие в молекуле одну тройную связь и имеющие общую формулу Cn
H2
n
-2
. Родоначальником гомологического ряда этих углеводородов является ацетилен HCºCH.
Изомерия
Алкинам свойственна изомерия углеродного скелета (начиная с C5
H8
), изомерия положения тройной связи (начиная с C4
H6
) и межклассовая изомерия с алкадиенами.
Получение
1) В промышленном масштабе для технических целей ацетилен получают высокотемпературным пиролизом метана.
2CH4
––1500
°
C
® HCºCH + 3H2
2) Алкины можно получить из дигалогенопроизводных парафинов отщеплением галогеноводорода при действии спиртового раствора щелочи. Атомы галогена при этом могут быть расположены как у соседних атомов углерода, так и у одного углеродного атома.
| СH3
–CH–CH2
+ 2 KOH ––этанол
® CH3
–CºCH + 2KBr + 2H2
O I I Br Br |
| Br I CH3 –C–CH2 –CH3 + 2KOH ––этанол ® CH3 –CºC–CH3 (бутин-2) + 2KBr + 2H2 O I Br |
3) Ацетилен получают также из ацетиленида (карбида) кальция при разложении его водой.
CaC2
+ 2H2
O ® Ca(OH)2
+ HCºCH
Физические свойства
По физическим свойствам алкины напоминают алкены и алканы. Температуры их плавления и кипения увеличиваются с ростом молекулярной массы. В обычных условиях алкины С2
–С3
– газы, С4
–С16
– жидкости, высшие алкины – твердые вещества. Наличие тройной связи в цепи приводит к повышению температуры кипения, плотности и растворимости их в воде по сравнению с олефинами и парафинами. Физические свойства некоторых алкинов сведены в таблице.
Таблица. Физические свойства некоторых алкинов
| Название | Формула | t°пл., °C |
t°кип., °C |
d4 20 |
| Ацетилен | HCºCH | -80,8 | -83,6 | 0,565 1 |
| Метилацетилен | CH3 –CºCH | -102,7 | -23,3 | 0,670 1 |
| Бутин-1 | C2 H5 –CºCH | -122,5 | 8,5 | 0,678 2 |
| Бутин-2 | CH3 –CºC–CH3 | -32,3 | 27,0 | 0,691 |
| Пентин-1 | CH3 –CH2 –CH2 –CºCH | -98,0 | 39,7 | 0,691 |
| Пентин-2 | CH3 –CH2 –CºC–CH3 | -101,0 | 56,1 | 0,710 |
| 3-Метилбутин-1 | CH3
–CH–CºCH I CH3 |
– | 28,0 | 0,665 |
1 При температуре кипения. 2 При 0°C. |
||||
Химические свойства
Углеродные атомы в молекуле ацетилена находятся в состоянии sp-гибридизации. Это означает, что каждый атом углерода обладает двумя гибридными sp- орбиталями, оси которых расположены на одной линии под углом 180° друг к другу, а две p- орбитали остаются негибридными.
![]()
sp- Гибридные орбитали двух атомов углерода в состоянии,
предшествующем образованию тройной связи и связей C–H

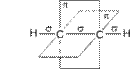
Схематическое изображение строения молекулы ацетилена (ядра атомов углерода и водорода на одной прямой,
две p- связи между атомами углерода находятся в двух взаимно перпендикулярных плоскостях)
I. Реакции присоединения
1) Гидрирование. Гидрирование алкинов осуществляется при нагревании с теми же металлическими катализаторами (Ni, Pd или Pt), что и в случае алкенов, но с меньшей скоростью.
CH3 –CºCH(пропин) ––t ° , Pd ; H 2• ® CH3 –CH=CH2 (пропен) ––t ° , Pd ; H 2 ® CH3 –CH2 –CH3 (пропан)
2) Галогенирование. Алкины обесцвечивают бромную воду (качественная реакция на тройную связь). Реакция галогенирования алкинов протекает медленнее, чем алкенов.
HCºCH ––Br
2
® CHBr=CHBr(1,2- дибромэтен) ––Br
2
® CHBr2
–CHBr2
(1,1,2,2- тетрабромэтан)
3) Гидрогалогенирование. Образующиеся продукты определяются правилом Марковникова.
CH3 –CºCH ––HBr ® CH3 –CBr=CH2 (2- бромпропен -1) ––HBr ® CH3 –CBr2 –CH3 (2,2- дибромпропан)
4) Гидратация (реакция Кучерова). Присоединение воды осуществляется в присутствии сульфата ртути. Эту реакцию открыл и исследовал в 1881 году М.Г.Кучеров.
Присоединение воды идет по правилу Марковникова, образующийся при этом неустойчивый спирт с гидроксильной группой при двойной связи (так называемый, енол) изомеризуется в более стабильное карбонильное соединение - кетон.
| C2 H5 –CºCH + H2 O ––HgSO4 ® [C2 H5 – | C=CH2
](енол) ® C2
H5
– I ø OH |
C–CH3
(метилэтилкетон) II O |
В случае гидратации собственно ацетилена конечным продуктом является альдегид.
| O II |
||
| HCºCH + H2
O ––HgSO4
® [CH2
= |
CH](енол) ® CH3
– I |
C(уксусный альдегид) I |
| H | O | H |
5) Полимеризация. Ацетиленовые углеводороды ввиду наличия тройной связи склонны к реакциям полимеризации, которые могут протекать в нескольких направлениях:
a) Под воздействием комплексных солей меди происходит димеризация и линейная тримеризация ацетилена.
HCºCH ––kat . HC º CH ® CH2 =CH–CºCH ––kat . HC º CH ® CH2 =CH–CºC–CH=CH2
b) При нагревании ацетилена в присутствии активированного угля (реакция Зелинского) осуществляется циклическая тримеризация с образованием бензола.
| + | ––600 ° C,C ® |  |
II. Кислотные свойства
HCºCH ––NaNH 2 ® HCºCNa + NH3
HCºCH + 2[Ag(NH3 )2 ]OH® AgCºCAg + 4NH3 + 2H2 O
AgCºCAg + 2HCl ® HCºCH + 2AgCl¯
Применение
Похожие работы
-
Алканы
Алканы - это предельные углеводороды, в молекулах которых все атомы связаны одинарными связями. Формула - Физические свойства Температуры плавления и кипения увеличиваются с молекулярной массой и длиной главной углеродной цепи
-
Характеристика углеводородов
ДИЕНОВЫЕ УГЛЕВОДОРОДЫ (АЛКАДИЕНЫ) Диеновые углеводороды или алкадиены – это непредельные углеводороды, содержащие две двойные углерод - углеродные связи. Общая формула алкадиенов CnH2n-2.
-
Углеводороды (таблица)
Предельные углеводороды . Непредельные углеводороды . Ароматические или Арены Алканы Циклоалканы Алкены Диеновые Алкины 1.Общая формула CnH2n -МЕТАН
-
Химия (Шпаргалка)
Метан C2 H6 Этан C3 H8 Пропан C4 H10 Бутан C5 H12 Пентан C6 H14 Гексан C7 H16 Гептан C8 H18 Октан C9 H20 Нонан C10 H22 Декан 1.Все атомы, образ. молекулы орган. вещ-в, связаны в опред. послед. согласно их валентностям.
-
Химия
Вопросы Гомологические ряды Алканы Алкены Алкины Общее понятие Общая формула 2n+2 2n-2 Тип гибридизации Число сигма связей 4.Наличие других видов связи
-
Таблица по разделу Органическая химия
Предельные углеводороды . Непредельные углеводороды . Ароматические или Арены Алканы Циклоалканы Алкены Диеновые Алкины 1.Общая формула CnH2n -МЕТАН
-
Получение алканов, алкенов, алкинов. Важнейшие представители. Применение в промышленности
Министерство образования Р.Ф. Курская государственная сельскохозяйственная академия им. Проф. И. И. Иванова РЕФЕРАТ ПО Органической химии ТЕМА: ПОЛУЧЕНИЕ АЛКАНОВ,АЛКЕНОВ,АЛКИНОВ.
-
Нефть
Реферат на тему “Нефть”. Нефть -масляная горючая жидкость обычно темного цвета со своеобразным запахом она немного легче воды и в ней не растворяется.
-
Диеновые углеводороды
К диеновым углеводородам относятся органические соединения с общей формулой , в молекулах которых имеются две двойные связи. глеводородов с двумя двойными связями очень много. Практически значимыми диеновыми углеводородами являются 1,3- бутадиен, или дивинил CH
-
Предельные углеводороды
Алканы - предельные углеводороды, содержащие только простые связи углерода. Получение алканов: промышленный метод, нитрование и окисление. Углеводороды, содержащие двойную связь углерода - алкены или этиленовые углеводороды. Диеновые углеводороды.