Название: Простые эфиры. Краун-эфиры. Представления о межфазном катализе. Реакции простых эфиров
Вид работы: реферат
Рубрика: Химия
Размер файла: 92.8 Kb
Скачать файл: referat.me-368478.docx
Краткое описание работы: Понятие простых эфиров, их сущность и особенности, общая формула, характеристика и химические свойства, образование названий. Отличительные черты циклических эфиров, причины их распространения и сферы использования. Представления и межфазном катализе.
Простые эфиры. Краун-эфиры. Представления о межфазном катализе. Реакции простых эфиров
Введение
Простыми эфирами (этерами) называют соединения общей формулы ROR'. По номенклатуре ИЮПАК эфиры рассматриваются как алкоксиалканы. При этом больший радикал считается основным. Для простых эфиров чаще, чем для других классов соединений, применяется радикально-функциональная номенклатура. В этом случае названия образуют из названий радикалов R и R’, связанных с атомом кислорода, добавляя слово "эфир":
![]() или
или![]()
![]() или
или 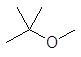
этоксиэтан 2-метокси-2-метилпропан
(диэтиловый эфир) (трет -бутилметиловый эфир, ТБМЭ)
Хорошими протонными растворителями для проведения реакций являются целлозольв и метилцеллозольв. Хорошим растворителем для поведения реакций гидроборирования и для восстановления гидроборатом натрия является диглим.
![]()
![]()
![]()
2-метоксиэтанол 2-этоксиэтанол диэтиленгликольдиэтиловый эфир
(метилцеллозольв) (целлозольв) (диглим)
Широкое применение находят циклические эфиры:
![]()
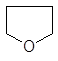
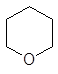
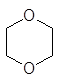
окись этилена тетрагидрофуран тетрагидропиран 1,4-диоксан
Простые эфиры имеют ту же геометрию, что и Н2 О (Гиллеспи). Валентный угол С-О-С соответстввует 112о для СН3 ОСН3 , что близко к тетраэдрическому углу и указывает на sp3 -гибридизацию атома кислорода.
Молекулы простых эфиров не могут образовывать водородные связи между собой, и поэтому они значительно более летучи, чем спирты с тем же числом атомов углерода. Плотность эфиров меньше, чем воды. Их растворимость в воде, с которой они могут образовывать водородные связи почти такая же как и у изомерных им спиртов, например, диэтиловый эфир и 1-бутанол растворяются в воде в количестве примерно 8 г на 100 мл воды.
Эфиры химически довольно инертны и поэтому широко используются в качестве растворителей. Многие эфиры имеют приятный запах и используются в парфюмерии.
(а) 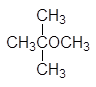 (б)
(б) 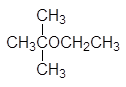 (в)
(в) 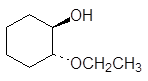
(г) ![]() (д)
(д) ![]()
Ответ:
(а) 2-метокси-2-метилпропани (трет -бутилметиловый эфир), (б) 2-метокси-2-метилпропани (трет -бутилэтиловый эфир), (в) транс -2-этоксициклогексанол, (г) метоксиэтен (винилметиловый эфир).
Краун-эфиры. Представления о межфазном катализе
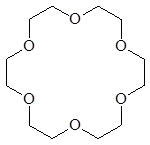
Краун-эфирами (точнее краун-полиэфирами) называют макроциклические полиэфиры, содержащие несколько атомов кислорода в цикле. Формально их можно рассматривать как продукты циклоолигомеризации окиси этилена. В названиях краун-эфиров первая цифра указывает на размер цикла, а вторая определяет число атомов кислорода в цикле.
Уникальное свойство краун-эфиров состоит в способности образовывать комплексы с солями щелочных металлов. Эти комплексы получаются за счет электростатического взаимодействия.
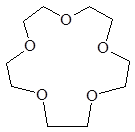
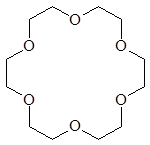
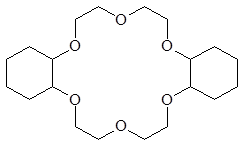
15-краун-5 18-краун-6 дициклогексан-18-краун-6
Способность к комплексообразованию проявляется уже при синтезе краун-эфиров. Так при обработке гидроксидом калия смеси триэтиленгликоля и получаемого из него дихлорида (хлорекса) их молекулы координируясь располагаются в пространстве таким образом, что становится возможной циклизация:
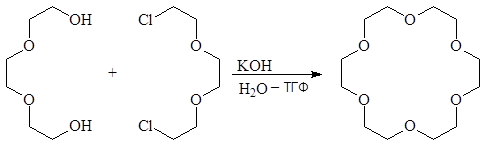 (28)
(28)
хлорекс 18-краур-6
Выход краун-эфиров очень сильно зависит от природы катиона основания. Наиболее высокий выход 18-краун-6-полиэфира достигается при использова-нии алкоголятов калия. Это указывает на то, что катион выполняет роль матри-цы при образовании цикла. Размер цикла определяется координационным числом катиона щелочного металла. Координационное число К+ по отношению к кислородсодержащим лигандам равно шести, поэтому катион калия наиболее эффективен при получении 18-краун-6-полиэфира с шестью атомами кислоро-да в цикле.
Влияние катиона на размер образующегося цикла получило название матричного, или «темплатного », эффекта. Краун-полиэфиры вступают во взаимодействие с катионами типа гость-хозяин :
 |
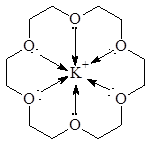 |
Краун-полиэфиры образуют стабильные комплексы с катионами переходных и непереходных металлов. Стабильность этих комплексов зависит от соответствия диаметра катиона размеру полости кольца, а также от координационного числа катиона металла.
ионLi+ Na+ K+ Rb+ Mg+ Ca+
диаметр, пм 136 194 266 294 164 286
(пикометр; 1 пм = 10-12 м или 1 пм = 0.01Å)
Краун-полиэфиры делают различные соли растворимыми в неполярных растворителях. Такие соли как KF, KCN и CH3 COOK могут быть перенесены в апротонные растворители используя каталитические количества 18-краун-6 и эти соли смогут участвовать в реакциях нуклеофильного замещения с органическими субстратами:
![]() (29)
(29)
В этих рекциях 18-краун-6 выполняет роль катализатора переноса фазы. Перенос реагента из одной фазы в другую (обычно из жидкой или твердой неорганической в жидкую органическую) называют межфазным катализом , а краун-эфиры – катализаторами межфазного переноса.
Реакции простых эфиров
Простые эфиры относятся к числу малореакционноспособных веществ и стабильны по отношению ко многим реагентам, особенно основной природы. Поэтому они широко используются в качестве растворителей. Сольватирующая способность эфиров как растворителей основана на их свойствах жестких оснований Льюиса. Как жесткие основания они образуют прочные комплексы с реактивами Гриньяра, литийорганическими соединениями, содержащими жесткие кислоты, _ катионы магния или лития.
Основные свойства простых эфиров
Поскольку атом кислорода обладает высокой электроотрицательностью и низкой поляризуемостью, простые эфиры являются слабыми n-основаниями Бренстеда и жесткими основаниями Льюиса. По этой же причине они способны образовывать оксониевые соли в безводной среде только с сильными кислотами Бренстеда (серной кислотой, галогеноводородами) и взаимодействовать с жесткими кислотами по Пирсону - хлоридами алюминия, цинка, олова(IV); трифторидом бора. Являясь жесткими основаниями Льюиса эфиры образуют очень прочные комплексы с жесткими кислотами Льюиса -BF3 , AlBr3 , AlR3 , SbCl5 , SbF5 , SnCl4 , ZnCl2 и т.д. состава 1:1 или 1:2:
Основными свойствами эфиров объясняется их хорошая растворимость в кислотах:
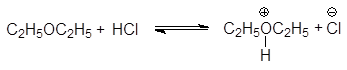 (9)
(9)
диэтилоксонийхлорид
![]() (10)
(10)
диэтилоксонийтрифторборат
Как основания Льюиса эфиры образуют комплексы с галогенами, в которых эфир играет роль донора, а галоген - акцептора пары электронов. Раствор йода в эфире окрашен в коричневый цвет в отличие от фиолетовой окраски йода в алканах.
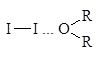 d- d+
d- d+
Такие комплексы получили название комплексов с переносом заряда (КПЗ).
Кислотное расщепление простых эфиров
Под действием галогенводородных кислот эфиры расщепляются через промежуточные оксониевые соли:
![]() (11)
(11)
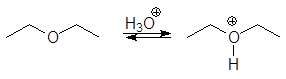 (М 4)
(М 4)
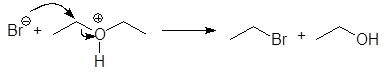
При избытке HBr спирт превращается во вторую молекулу этилбромида:
![]() (12)
(12)
избыток
Кислотное расщепление простых эфиров следует рассматривать как типичный случай реакции нуклеофильного замещения у насыщенного атома углерода. В зависимости от природы алкильных групп, связанных с кислородом, реализуется SN 2- или SN 1-механизм. Для расщепления требуются сильные кислоты и хорошие нуклеофилы HI (57%) и HBr (48%). Конц. HCl (38%) наименее эффективна потому что Cl- в воде является более слабым нуклеофилом, чем Br- и I- .
Особенно склонны к расщеплению третичные аллильные и бензильные эфиры. Третичный бутиловый эфир расщепляется соляной кислотой при обычной температуре по механизму SN 1:
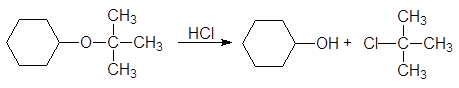 (13)
(13)
Радикальные реакции эфиров
Подобно алканам, простые эфиры вступают в реакцию радикального галогенирования, однако галогенирование эфиров отличается высокой региоселективностью и осуществляется в a-положение по отношению к атому кислорода:
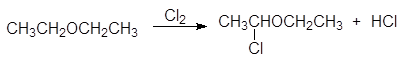 (14)
(14)
a-хлордиэтиловый эфир
Атом хлора в a-хлорэфирах очень подвижен и легко замещается.
Эфиры способны окисляться атмосферным кислородом и при долгом стоянии на воздухе в них накапливаются гидроперекиси, например:
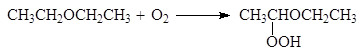 (15)
(15)
гидроперекись эфира
Перекиси разрушают натрием, солями железа (II) или марганца (II).
Похожие работы
-
Карбоновые кислоты и их производные
Одноосновные карбоновые кислоты. Общие способы получения. Двухосновные кислоты, химические свойства. Пиролиз щавелевой и малоновой кислот. Двухосновные непредельные кислоты. Окисление оксикислот. Пиролиз винной кислоты. Сложные эфиры. Получение жиров.
-
Реакция катализа и промышленные катализаторы
Содержание Роль катализа в промышленности и экологии. Определение катализа. Селективность. Общие представления о понятии "механизм химической реакции".
-
Углеводы
Применение синтеза моносахаридов по методу Килиани-Фишера для увеличения длины углеродной цепи альдозы на один атом углерода. Деградация альдоз по Руффу - декарбокислирование соли гликоновой кислоты. Мутаротация и химические свойства моносахаридов.
-
Сложные эфиры (эстеры)
Классификация, свойства, распространение в природе, основной способ получения эфиров карбоновых кислот путем алкилирования их солей алкилгалогенидами. Реакции этерификации и переэтерификация. Получение, восстановление и гидролиз сложных эфиров (эстеров).
-
Химия
Вопросы Гомологические ряды Алканы Алкены Алкины Общее понятие Общая формула 2n+2 2n-2 Тип гибридизации Число сигма связей 4.Наличие других видов связи
-
Реакции С и О ацилирования
Введение. Реакции ацилирования обладают очень многими полезными свойствами. Они позволяют вести в молекулу функциональную группу C=O путем реакций присоединения либо замещения, не подвергая исходную молекулу окислению (восстановлению). Таким образом, можно получать соединения различных классов: а) амиды; б) сложные эфиры; в) ангидриды карбоновых кислот; г) кетоны и другие полезные соединения.
-
Получение простых эфиров
Межмолекулярная дегидратацией спиртов. Синтез эфиров по реакции Вильямсона. Присоединение спиртов к алкенам. Синтез эфиров сольватомеркурированием - демеркурированием алкенов. Присоединение спиртов к алкинам. Триметилсилиловые эфиры. Силилирование.
-
Синтез и реакции Бис-(2,6-тремитилсилилокси)би-цикло[3.3.1]нонандиена-2,6
Основные методы получения силиловых эфиров енолов. Применение силиловых эфиров енолов в синтезе. Силиловые эфиры енолов как С-нуклеофилы. Синтез исходных соединений. Реакции бис-(2,6-триметилсилилокси) бициклов нонандиена-2,6. Реакция с электрофилами.
-
Свойства дикарбоновых кислот и их ангидридов
Сущность, общая формула и методика получения дикарбоновых кислот окислением циклических кетонов. Основные свойства всех дикарбоновых кислот и уникальные признаки некоторых представителей. Ангидриды, их свойства, методы получения и использование.
-
Cложные эфиры
Содержание стр. Введение -3- 1. Строение -4- 2. Номенклатура и изомерия -6- 3. Физические свойства и нахождение в природе -7- 4. Химические свойства -8-