Название: Теория Бутлерова 2
Вид работы: реферат
Рубрика: Химия
Размер файла: 27.23 Kb
Скачать файл: referat.me-368859.docx
Краткое описание работы: I. Строение молекулы метана. Молекулярная формула метана CH4. Так как атом углерода имеет большую электроотрицательность (2,5), чем водород (2,1), то в молекуле метана происходит незначительное смещение общих электронных пар в сторону атома углерода.
Теория Бутлерова 2
I. Строение молекулы метана.
Молекулярная формула метана CH4 .
Так как атом углерода имеет большую электроотрицательность (2,5), чем водород (2,1), то в молекуле метана происходит незначительное смещение общих электронных пар в сторону атома углерода.
Однако такая формула не отражает пространственного строения молекулы. Чтобы это показать, необходимо вспомнить о формулах электронных облаков и размещении электронов по энергетическим уровням и подуровням. Например, строение атома углерода изображают следующей схемой:
| 2P | |||
| ) ) | 2S | ↑ | ↑ |
| С +6 2 4 | S | ↑↓ | |
| ) ) | ↑↓ | 1S2 2S2 2P2 |
Так как на втором энергетическом уровне р-подуровне имеется свободная орбиталь, то на нее может перейти один из 2S2 – электронов:
| ) ) | |||
| С +6 2 4 | ↓ | ↓ | ↓ |
| ) ) | ↓ | ||
| S Sp | ↑↓ |
В результате все четыре наружных электрона второго энергетического уровня в атоме углерода окажутся неспаренными, и атом углерода в возбужденном состоянии становится четырехвалентным.
Чтобы понять, как происходит образование химических связей в молекуле метана перекрыванием электронных облаков и почему молекула метана имеет тетраэдрическое строение, нужно знать то, что эти облака после гибридизации распространяется в пространстве так, что их оси оказываются направленными к вершинам тетраэдры. При образовании молекул метана вершины этих гибридных облаков перекрываются с облаками электронов атомов водорода.
Так как в этом случае в гибридизации участвует один S-электрон и три p-электрона, то такой ее вид называется SP3 - гибридизацией.
Химическая формула и строение молекул этилена.
Молекулярная формула этилена C2 H4 .
Если между двумя взаимно связанными атомами углерода разместить четыре атома водорода, то структурную формулу этилена следовало бы изобразить так:
HH
| |
H – C – C – H
| |
Однако свободных связей в молекуле не должно быть. Поэтому в структурной формуле этилена изображают двойную связь:
HH
| |
H – C = C – H
Следовательно, в отличие от предельных углеводородов, в молекулах которых между атомами углерода имеется ординарная связь, в молекулах углеводородов ряда этилена между атомами углерода имеется одна двойная связь.
В молекуле этилена подвергаются гибридизации одно S- и два p – электронных облака атомов углерода. Таким образом каждый атом углерода имеет по три (всего шесть) гибридных электронных облака и по одному (всего два) негибридному p – облаку. Два из гибридных электронных облаков атомов углерода взаимно перекрываются и образуют между атомами углерода δ (сигма) – связь. Остальные четыре гибридных электронных облака атомов углерода перекрываются в той же плоскости с четыремя S – электронными облаками атомов водорода и также образуют четыре δ – связи. Негибридные два p-облака атомов углерода взаимно перекрываются в плоскости, которая расположена перпендикулярно плоскости δ – связи, т.е. образуется одна П-связь. Следовательно, в молекуле этилена между атомами имеется одна δ и одна П – связь. В углеродных соединениях П – связь значительно слабее, чем δ – связь. Под воздействием респектов П – связь легко разрывается.
Легко понять, что в молекулах предельных углеводов атомы углерода могут свободно вращаться вокруг δ – связи. Если же между атомами углерода существует не только δ – связь, но и П – связь, то такое вращение без разрыва последней невозможно.
II.
1.Изомерия цепи атомов углерода в различных органических соединениях
Впервые с этим видом изомерии мы встретились при изучении предельных углеводородов. Например, молекулярной формуле C5 H12 соответствуют три вещества:
CH3 – CH2 - CH2 - CH2 - CH3
Пентан
| CH3 | |
| | | |
| CH3 – CH – CH2 – CH3 | CH3 – C - CH3 |
| | | | |
| CH3 | CH3 |
| 2-метилбутан | 2,2 диметилпропан |
Этот вид изомерии встречается не только у предельных углеводородов, но и у других классов органических соединений. Так, например, в зависимости от строения углеродной цепи одной и той же молекулярной формуле С4 Н9 0Н соответствуют два спирта:
| CH3 | |
| 4 3 2 1 | 3 2| 1 |
| CH3 - CH2 - CH2 - CH2 - ОH | CH3 - CH – CH2 - ОH |
| 1-бутанол | 2-метил-1-пропанол |
Другой пример. Одной и той же молекулярной формуле C4 H9 O2 в зависимости от строения углеродной цепи соответствуют две аминокислоты:
| O | CH3 O |
| 4 3 2 1// | 3 2| 1// |
| CH3 – CH2 – CH – C | CH3 – C – C |
| | | | |
| NH2 | NH2 OH |
| 2-аминобутановая кислота | 2-амино-2-метил-пропановая кислота |
2. Изомерия положения двойной или тройной связи в молекуле
С этим видом изомерии мы встретились при изучении непредельных углеводородов. Так, например, молекулярной формуле C4 H6 в зависимости от места расположения тройной связи соответствуют два вещества:
CH3 – CH2 – C ≡ CH CH3 – C ≡С - CH3
1- бутин 2-бутин
Другой пример. Одной и той же молекулярной формуле С4 Н6 02 в зависимости от места двойной связи соответствуют две непредельные карбоновые кислоты:
| O | O |
| // | // |
| CH2 = CH – CH2 - C | CH3 - CH = CH - C |
| ОН | ОН |
| Винилуксусная кислота | Кротоновая кислота |
3. Изомерия положения функциональной группы или отдельных атомов в молекуле.
С этим видом изомерии мы ознакомились при изучении спиртов, аминокислот, а также галогенопроизводных углеводородов. Рассмотрим несколько примеров.
Молекулярной формуле С3 Н7 ОН в зависимости от положения гид роке ильной группы в молекуле соответствуют два вещества:
| CH3 - CH – CH3 | |
| CH3 - CH2 - CH2 - ОH | | |
| ОH | |
| 1-пропанол | 2-пропанол |
Молекулярной формуле С3 Н7 О2 Nв зависимости от положения аминогруппы — NH2 в молекуле соответствуют два вещества:
| O | O |
| 3 2 // | // |
| NH2 - CH2 – CH2 - C | CH3 - CH – C |
| ОН | ОН |
| 3-аминопропановая кислота | 2-аминопропановая кислота |
Молекулярной формуле С3 Н7 Сlв зависимости от положения атома хлора в молекуле тоже соответствуют два вещества:
CH3 – CH2 – CH2 - Cl CH3 – CНCl - CH3
1-хлорпропан 2-хлорпропан
4. Пространственная, или стереоизомерия. Этот вид изомерии встречается у непредельных углеводородов, в составе которых имеются разные атомы или группы атомов, способные занимать различные положения в пространстве. Например, олеиновая кислота С17 Н33 СООН существует в двух изомерных формах:
| Н Н | CH3 – (CH2 )7 Н |
| / | / |
| С = С | С = С |
| / | / |
| CH3 – (CH2 )7 (CH2 )7 - СООН | Н (CH2 )7 - СООН |
| Цис-изомер | транс-изомер |
Этим же видом изометрии обусловлена стереорегулярность и стереонерегулярность различных полимеров. Характерным примером регулярного строения является дивиниловый каучук
| H H | |
| / | |
| C = C | |
| / | |
| -CH2 CH2 - | n |
А примером нерегулярного строения-бутадиеновый каучук
| H CH2 - | |
| / | |
| C = C | |
| / | |
| -CH2 H | n |
которые существенно отличаются по свойствам.
5. Изомерия, характерная для органических соединений, в молекулах которых имеется бензольное кольцо.
Этот вид изомерии возможен при наличии двух заместителей в бензольном кольце. В зависимости от расположения заместителей в бензольном кольце различают орто-, мета- и пара-изомерию. Так, например, если в бензольном кольце имеется два заместителя — радикал метил и гидроксильная группа, то такое вещество называется крезолом. И в зависимости от расположения этих групп в бензольном кольце существует три различных вещества:
C-CH3 HC C-OH HC CH CH |
C-CH3 HC CH HC C-OH CH |
C-CH3 HC CH HC CH C-OH |
| о-крезол | м-крезол | n-крезол |
Следует учесть, что многие соединения, имеющие одну и ту же молекулярную формулу, могут отличаться между собой различными видами изомерии, например:
| CH3 O | O |
| | // | // |
| CH3 – C – C | NH2 – CH2 – CН – C |
| | | | |
| NH2 OH | CH3 OH |
| 2-амино-2метилпропановая кислота | 3-амино-2-метилпропановая кислота |
| CH3 – CH2 – CH – CООН |
| | |
| NH2 |
| 2-аминобутановая кислота |
Эти изомерные вещества отличаются одновременно изометрией углеродной цепи и изометрией положения функциональной группы – NH2 .
III. Например, из молекулы этанола натрий вытесняет только один атом водорода. Следовательно, этот атом водорода более подвижен.
Отсюда можно вывести структурную формулу этанола:
H H
| |
H – C – C – H
| |
HH
Наоборот, зная структурную формулу этанола, можно предвидеть, что натрий будет вытеснять только один атом водорода, который связан с атомом кислорода.
Изучая свойства глюкозы, мы убедились, что в ее молекуле пять групп – он и одна альдегидная группа. Наоборот, зная структурную формулу глюкозы, можно предвидеть, что глюкоза будет проявлять свойства альдегидов и спиртов.
IV. Химические свойства фенола обусловлены наличием в его молекуле гидроксильной группы и бензального ядра, которые взаимно влияют друг на друга. Наличие гидроксильной группы предопределяет сходство фенола со спиртами:
1. Сходство, сходное со свойствами спиртов:
2C6 H5 OH + 2 Na → 2C6 H5 ONa + H2 ↑
2. Свойство, отличающееся от свойств спиртов:
C6 H5 OH + NaOH → C6 H5 ONa + H2 O
3.
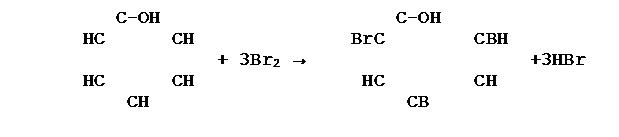 |
Реакция бромирования
4. Реакция нитрования
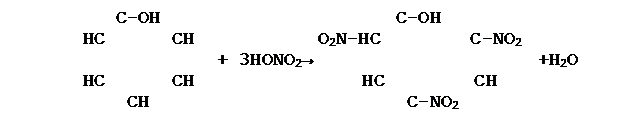 |
Влияние бензольного ядра на гидроксильную группу обуславливает большую подвижность ее водородного атома. Поэтому фенол, в отличие от спиртов, реагирует со щелочами, т.е. обладает свойствами слабых кислот. Его иногда называют карболовой кислотой. Это объясняется тем, что бензольное ядро оттягивает к себе электроны кислородного атома гидроксильной группы. Чтобы компенсировать это, атом кислорода сильнее притягивает к себе электронную плотность от атома водорода. Вследствие этого кавалентная связь между атомами кислорода и водорода становится более полярной, а атом водорода – более подвижным. Гидроксильная группа в свою очередь придает атомам водорода большую подвижность в положении 2, 4, 6. Это один из многих примеров, подтверждающих тезис теории А.М. Бутлерова о взаимном влиянии атомов в молекулах.
Химические свойства анилина обусловлены наличием в его молекуле аминогруппы - NH2 и бензольного ядра. Анилин более слабое основание. Чтобы ответить на этот вопрос, нужно вспомнить о взаимном влиянии атомов и атомных групп в молекулах. Как и в молекулах фенола (об этом говорилось раньше) бензольное ядро несколько оттягивает свободную электронную пару от атома азота аминогруппы. Вследствие этого электронная плотность на атоме азота в молекуле анилина уменьшается и он слабее притягивает к себе протоны, т.е. основные свойства анилина ослабляются. Важнейшие свойства анилина:
1. Реагирует с кислотами с образованием солей:
C6 H5 – NH2 + HCl → C6 H5 NH3 Cl
2. Образовавшиеся соли реагируют со щелочами и снова выделяются анилин:
C6 H5 – NH3 Cl+ NaOH → C6 H5 NH2 + Na Cl + H2 O
3. Энергично участвует в реакциях замещения, например реагирует с бромной водой с образованием 2, 4, 6 – триброманилина:
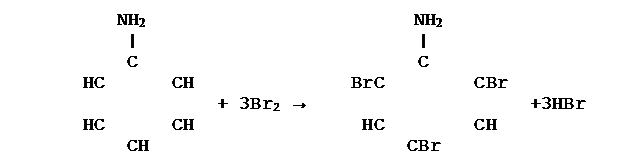 |
Взаимное влияние атомов в молекулах галогенопроизводных углеводород.
Самое характерное химическое свойство предельных углеводородов – реакции замещения. Примером такой реакции является взаимодействие предельных углеводородов с галогенами. Аналогично с галогенами реагируют и другие предельные углеводороды:
CH3 -CH3 +Cl2 → CH3 -CH2 -Cl+HCl
Галогенопроизводные углеводороды обладают некоторыми особенностями. Согласно теории А.М. Бутлерова, это объясняется взаимным влиянием атомов и атомных групп в химических соединениях. С точки зрения современных представлений об электронных облаках и их взаимном перекрывании, с учетом электроотрицательности химических элементов взаимное влияние атомов и атомных групп, например в метилхиориде, объясняется так. У атомов хлора электроотрицательность больше, чем у атомов углерода. Поэтому электронная плотность связи смещена от атома углерода в сторону атома хлора. Вследствие этого атом хлора приобретает частичный отрицательный заряд, а атом углерода – частичный положительный заряд. Приобретаемые частичные заряды обозначаются δ+ и δ- :
| H | H |
| δ+ δ- | ↓ |
| H- C → Cl или | H → C → Cl |
| / | ↑ |
| H | H |
Влияние атома хлора распространяется не только на атом углерода, но и на атомы водорода. Из-за этого электронная плотность атомов водорода смещается в сторону атома углерода и химические связи между атомами водорода и углерода становится более полярными. В результате атомы водорода в молекуле метилхлорида оказываются менее прочно связанными с атомом углерода и легче замещаются на хлор, чем первый атом водорода в молекуле метана. Из-за смещения электронных плотностей от атома водорода к атому углерода значение положительного заряда последнего уменьшается. Поэтому ковалентная связь между атомами углерода и хлора становится менее полярной и более прочной.
С точки зрения ионного механизма сущность правила В.В. Марковникова при взаимодействии пропилена с бромоводородом объясняется следующим образом: в молекуле пропилена в результате сдвига электронной плотности второй атом углерода, который связан с метилрадикалом заряжен более положительно, чем первый.
Значение электроотрицательности у атомов углерода больше, чем у атомов водорода. Поэтому третий атом углерода метильной группы в результате сдвига электронной плотности от трех атомов водорода приобретает относительно больший отрицательный заряд, чем другие атомы углерода. Этот избыточный отрицательный заряд в свою очередь смещает подвижные П-электронные облака от второго к первому атому углерода. В результате такого сдвига первый атом углерода приобретает больший отрицательный заряд, а второй становится более положительным. В результате атом водорода (+) присоединяется к атому углерода (-), а галоген (-) – к атому углерода (+).
Бензол очень стоек к окислению. В отличие от него ароматические углеводороды с боковыми цепями окисляются относительно легко.
1. При действии энергичных окислителей (KMnO4 ) на гомолоне бензола окислению подвергаются только боковые цепи. Если, например, в пробирку налить 2-3 мл толуола, затем добавить к нему раствор перманганата калия и нагреть, то можно заметить, что фиолетовая окраска раствора постепенно обесцвечивается. Это происходит потому, что по действием перманганата калия метильная группа толуола окисляется и превращается в группу
| O |
| // |
| - C |
| OH |
| O |
| // |
| C6 H5 -CH3 +3O → C6 H5 -C + H2 O |
| OH |
Известно, что метан и другие предельные углеводороды весьма устойчивы к действию окислителей. Однако метильная группа в молекуле толуола окисляется сравнительно легко. Это объясняется влиянием бензольного кольца. Из приведенных примеров реакций замещения и окисления следует, что не только метильная группа влияет на бензольное кольцо, но и бензольное кольцо влияет на метильную группу, т.е. их влияние зависимо.
Похожие работы
-
Типы химических связей
Электростатическая связь: виды взаимодействий. Свойства ковалентных связей (длина, полярность и энергия). Средняя величина дипольных моментов связей и функциональных групп. Строение метана. Строение молекул с n, o-атомами с неподеленной парой электронов.
-
Метан
Атом углерода в молекуле метана находится в состоянии гибридизации.В результате перекрывания четырёх гибридных орбиталей атома углерода с орбиталями
-
Химия (Шпаргалка)
Метан C2 H6 Этан C3 H8 Пропан C4 H10 Бутан C5 H12 Пентан C6 H14 Гексан C7 H16 Гептан C8 H18 Октан C9 H20 Нонан C10 H22 Декан 1.Все атомы, образ. молекулы орган. вещ-в, связаны в опред. послед. согласно их валентностям.
-
Химия
Природный газ одного из месторождений содержит 92% метана, 4% этана, , 1% пропана, 2% углекислого газа и 1% азота (по объему). Какой объем кислорода потребуется для сжигания 200 л этого газа?
-
Решение задач по химии
Решебник разноуровневых заданий по химии для дифференцированного контроля знаний учеников 8 класс г. Кривой Рог 2001 год Вариант 1 Задачи Первый уровень
-
Попутный и природный нефтяные газы
Газы нефтяные попутные – это природные газы, сопровождающие нефть и выделяющиеся при ее добыче. Характерной особенностью состава газов нефтяных попутных является наличие в них, кроме метана, также этана, пропана, бутанов и паров более тяжелых углеводородов. Во многих газах нефтяных попутных присутствуют сероводород и негорючие компоненты: азот, углекислый газ, а также редкие газы – He, Ar.
-
Метан
Наиболее важный представитель органических веществ в атмосфере. Природа естественных и антропогенных источников метана. Доли отдельных источников в общем потоке метана в атмосферу. Повышение температуры атмосферы.
-
Характеристика ацетиленовых углеводородов
АЦЕТИЛЕНОВЫЕ УГЛЕВОДОРОДЫ (АЛКИНЫ) Ацетиленовыми углеводородами (алкинами) называются непредельные (ненасыщенные) углеводороды, содержащие в молекуле одну тройную связь и имеющие общую формулу CnH2n-2. Родоначальником гомологического ряда этих углеводородов является ацетилен HCCH.
-
Разработка урока по теме: "Метан, его строение и валентные состояния атома углерода"
Представление о строении метана (молекулярная, электронная и структурная формулы). Физические свойства, нахождение в природе, тип химической связи и пространственное строение молекулы и атома углерода в трёх валентных состояниях, понятие гибридизации.
-
Алифатические предельные углеводороды и их строение
Особенности строения предельных углеводородов. Номенклатура углеводородов ряда метана. Химические свойства предельных углеводородов, их применение. Структурные формулы циклопарафинов (циклоалканов), их изображение в виде правильных многоугольников.