Название: Гетероциклы.Классификация и описание свойств
Вид работы: реферат
Рубрика: Химия
Размер файла: 254.12 Kb
Скачать файл: referat.me-370216.docx
Краткое описание работы: Гетероциклические соединения Гетероциклическими называются соединения, имеющие в своем составе кольца (циклы), в образовании которых, кроме атомов углерода, принимают участие и атомы других элементов.
Гетероциклы.Классификация и описание свойств
Гетероциклические соединения
Гетероциклическими называются соединения, имеющие в своем составе кольца (циклы), в образовании которых, кроме атомов углерода, принимают участие и атомы других элементов.
Атомы других элементов, помимо атомов углерода, входящие в состав гетероциклов, называются гетероатомами. Наиболее часто встречаются в составе гетероциклов гетероатомы азота (N), кислорода (O) и серы (S).
Классификация гетероциклов
1. по общему числу атомов в цикле: трех-, четырех-, пяти-, шестичленные циклы и др.
2. по природе гетероатома: кислородо-, азото-, серо-, фосфорсодержащие
3. По числу гетероатомов:1,2 и более в цикле
4. По степени насыщенности циклов
5. По количеству циклов
Наибольшее значение имеют пяти и шестичленные гетероциклы, содержащие азот, кислород и серу. Эти циклы образуются наиболее легко и отличаются большой прочностью. Это обусловлено тем, что валентные углы приведенных гетероатомов незначительно отличаются от валентного угла углерода. По степени насыщенности гетероциклические соединения могут быть насыщенными, ненасыщенными и ароматическими. Особо следует выделить гетероциклические соединения, которые по своим свойствам отличаются от всех остальных циклических и ациклических соединений, напоминая своей устойчивостью и реакциями скорее бензол и его производные. Это гетероциклические соединения ароматического характера.
Гетероциклические соединения имеют огромное значение. Многие из них являются основой важных лекарственных препаратов, участвуют в построении некоторых аминокислот, входящих в состав белков. Гетероциклы являются структурными компонентами нуклеиновых кислот, лежат в основе природных окрашенных веществ таких, как хлорофилл, гемоглобин.
Гетероциклические соединения ароматического характера
В гетероциклических соединениях ароматического характера встречаются только следующие гетероатомы: азот, кислород и сера. Они являются единственными элементами, кроме углерода, которые могут образовывать π-связи и, следовательно, участвовать в построении ароматических ядер.
Пятичленные гетероциклы с одним гетероатомом
Важнейшими пятичленными гетероциклами с одним гетероатомом являются:
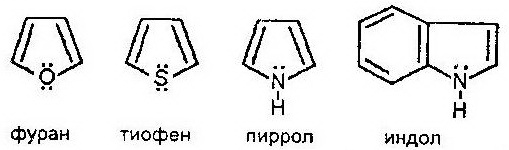
Индол (бензпиррол) является примером конденсированного гетероциклического соединения, в состав которого входят бензольное и пиррольное ядра, имеющие общее сочленение.
Производные пиррола широко распространены в природе. Сам же пиррол встречается редко. Он входит в состав каменноугольной смолы и костяного масла. Целый ряд производных пиррола и индола был получен искусственно и занял важное место в промышленном органическом синтезе: красители, лекарственные препараты, пластики. Индол является структурным компонентом незаменимой аминокислоты триптофан.
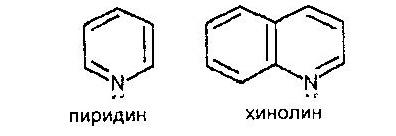
Шестичленные гетероциклы с одним гетероатомами
Важнейшим шестичленным гетероциклом с одним гетероатомом азота является пиридин. Наряду с пиридином большое значение имеют конденсированные системы, в которых ядро пиридина сочетается с одним и двумя ядрами бензола. Например, хинолин.
Пятичленные и шестичленные гетероциклы с двумя гетероатомами
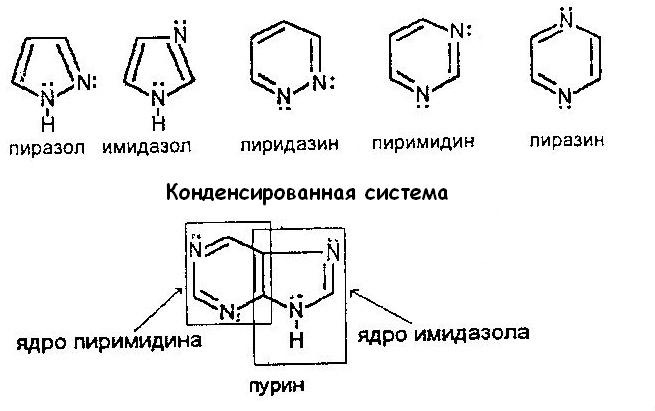 В азотосодержащих гетероциклах два атома азота могут быть расположены в непосредственном соседстве и могут быть разделены одной или двумя группами CH (1,2-, 1,3- и 1,4- расположение).
В азотосодержащих гетероциклах два атома азота могут быть расположены в непосредственном соседстве и могут быть разделены одной или двумя группами CH (1,2-, 1,3- и 1,4- расположение).
Пурин – сложная гетероциклическая система, состоящая из двух конденсированных гетероциклов: пиримидина и имидазола.
Критерии ароматичности
1. Плоская циклическая система
2. Замкнутая, сопряженная система, охватывающая все атомы цикла
3. Число электронов, участвующих в сопряжении равно 4n+2, где n=0,1,2,3,… (n- количество циклов)
В гетероциклических соединениях с одним циклом, в сопряжении участвуют 6 электронов
Строение бензола по схеме
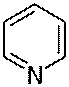
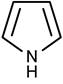 Пиридин. Как и в случае бензола, ароматический характер пиридина обусловлен сопряжением шести p-электронов (ароматический секстет) по одному от каждого атома цикла. Атом азота (пиридиновый) связан с двумя соседними атомами углерода sp2
-гибридизованными орбиталями аналогично атомам углерода в бензоле. Межатомные расстояния C-C в пиридине равны между собой и практически равны расстояниям C-C в бензольном ядре; расстояния C-N значительно меньше тех же расстояний в несопряженных молекулах. Неподеленная электронная пара на sp2
-АО азота не участвует в сопряжении. Именно она и обуславливает основные свойства пиридина.
Пиридин. Как и в случае бензола, ароматический характер пиридина обусловлен сопряжением шести p-электронов (ароматический секстет) по одному от каждого атома цикла. Атом азота (пиридиновый) связан с двумя соседними атомами углерода sp2
-гибридизованными орбиталями аналогично атомам углерода в бензоле. Межатомные расстояния C-C в пиридине равны между собой и практически равны расстояниям C-C в бензольном ядре; расстояния C-N значительно меньше тех же расстояний в несопряженных молекулах. Неподеленная электронная пара на sp2
-АО азота не участвует в сопряжении. Именно она и обуславливает основные свойства пиридина.
Пиррол. Ароматический секстет пиррола образуется сочетанием четырех p-элетронов углерода и двух неподеленных электронов азота на pz -АО с образованием единой π-электронной системы. Атом азота в этом случае называется пиррольным.
Наличие гетероатома приводит к неравномерному распределению электронной плотности. Влияние гетероатома меняется в зависимости от того, один или два p-электрона вносит он в ароматический секстет. Распределение электронной плотности, длины связей и валентные углы в молекулах пиридина и пиррола приведены на рисунке. Так как электроотрицательность азота больше, чем углерода, то в пиридине электронная плотность увеличена у атома азота и понижена у остальных атомов цикла, главным образом у атомов в положениях 2,4 и 6.
Вследствие участия пары неподеленных электронов атома азота пиррола в ароматическом сопряжении гетероатом становится более бедным электронами. CH- группы, находящиеся по соседству с гетероатомом (α-положения), будут значительно богаче электронами и, следовательно, более реакционноспособными в реакциях электрофильного замещения, чем более удаленные CH-группы (β-положения)
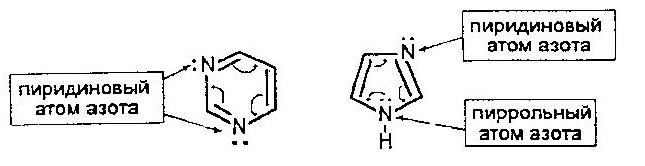
Пиримидин содержит два пиридиновых атома азота, а имидазол и пурин – пиррольный и пиридиновый атомы азота. Это определяет кислотно-основные свойства данных соединений.
Пиррол. Бесцветная жидкость, слабо растворима в воде, на воздухе быстро окисляется и темнеет. Получение:
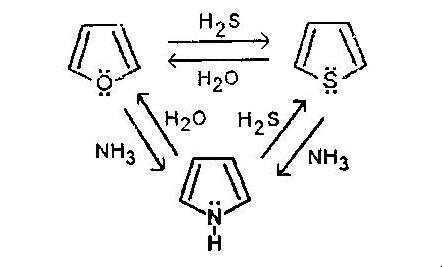
1. Фуран, тиофен и пиррол могут превращаться в друг друга при нагревании до 400-450 в присутствии катализатора Al2 O3 (цикл Юрьева)
2. Пиррол образуется при пропускании смеси C2 H2 и NH3 через нагретый katFe2 O3
Химические свойства
1. Пиррол проявляет слабокислотные свойства, реагируя со щелочными Me или с очень сильными основаниями при t.
2. Легче чем бензол вступает в реакции замещения. Распределение электронной плотности, обусловленное наличием гетероатома таково, что наиболее реакционноспособными являются альфа-положения по отношению к атому азота.
3. При восстановлении в мягких условиях (Zn+HCl) пиррол превращается в пирролин. Энергичное восстановление (например, гидрирование в присутствии никеля при 200) приводит к образованию тетрагидропиррола (пирролидина).
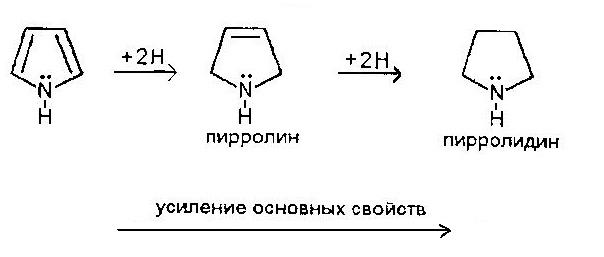 Основные свойства пиррола практически не проявляются из-за участия неподеленной электронной пары в системе кольцевого сопряжения (пиррольный азот). В ряду пиррол – пирролин – пирролидин, основность растет.
Основные свойства пиррола практически не проявляются из-за участия неподеленной электронной пары в системе кольцевого сопряжения (пиррольный азот). В ряду пиррол – пирролин – пирролидин, основность растет.
Ядро пиррола и некотрые его производные входят в состав важнейших биологических и биохимических структур. Например. пиррольные циклы входят в состав порфина и гемма. При их разрушении в организме образуются «линейные» тетрапирролы, называемые желчными пигментами (биливердин, билирубин, стеркобилин и т.д.). По соотношению пигментов определяются вид желтухи и причины, вызывающие заболевание (механическая желтуха, вирусный гепатит и т.д.)
Пиридин. Бесцветная жидкость с характерным неприятным запахом, с водой смешивается в любых соотношениях. Получение:
1. Выделение из каменноугольной смолы
2. Синтез из синильной кислоты и ацетилена
Химические свойства
1. Пиридин обладает основными свойствами, т.к. содержит ПИРИДИНОВЫЙ атом азота, в известной степени аналогичный атому азота аминов (электронная пара не участвует в образовании ароматического секстета):
2. Водные раствора пиридина окрашивают лакмус в синий цвет, при действии минеральных кислот образуются кристаллические пиридиниевые соли
3. Пиридин и его гомологи присоединяют галоген алкилы, давая соли пиридиния
4. Пиридин труднее бензола вступает в реакции замещения из-за большей чем у углерода, электроотрицательности атома азота. При этом замещение идет приемущественно по β-положения
5. При каталитическом восстановлении пиридин переходит в пиперидин
6. Пиридин устойчив к действию окислителей. Его гомологи окисляются с образованием гетероциклических карбоновых кислот
7. Горение пиридина
Пиридин и его производные основа многих лекарственных средств. Например – никотиновая кислота и ее амид являются витаминами группы PP.
Нуклеиновые основания
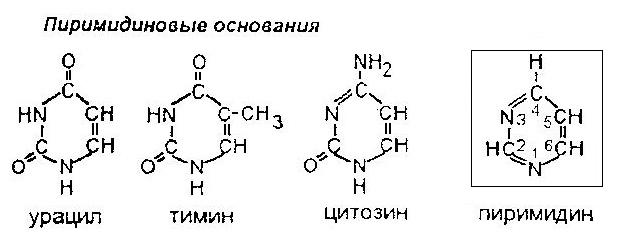 Из ранее изложенного следует, что соединения, содержащие пиридиновый атом азота, обладают основными свойствами (азотистые основания). Производные пиримидина и пурина, входящие в состав нуклеиновых кислот. получили название «нуклеиновые основания».
Из ранее изложенного следует, что соединения, содержащие пиридиновый атом азота, обладают основными свойствами (азотистые основания). Производные пиримидина и пурина, входящие в состав нуклеиновых кислот. получили название «нуклеиновые основания».
Кислородные производные азотосодержащих гетероциклов в зависимости от условий могут существовать в различных таутомерных формах, переходящих друг в друга благодаря ЛАКТИМ-ЛАКТАМНОЙ ТАУТОМЕРИИ. Например, для урацила:
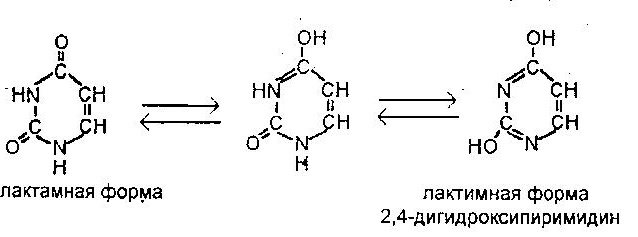
Таутомерия – это равновесная динамическая изомерия. Сущность ее заключается во взаимномпревращении изомеров с переносом какой-либо подвижной группы и соответствующем перераспределении электронной плотности.
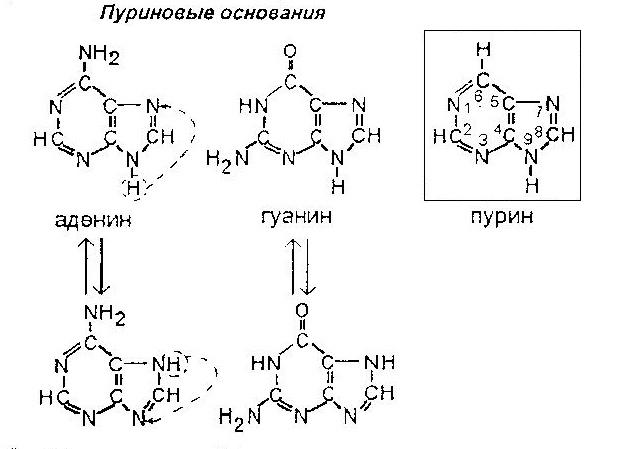
В пурине, аденине и гуанине происходит миграция водорода между N-7 и N-9. Для гуанина также имеет место лактим-лактамная таутомерия. Оксоформа более устойчива при физиологических значениях pH.
Похожие работы
-
Индол. Порфин. Тетраазапорфин. Фталоцианины
Понятие и характеристика таких соединений как: индол, порфин, тетраазапорфин и фталоцианин, их описание и характеристика. Свойства химических соединений и методика их получения. Реакции электрофильного замещения. Восстановление соединений и окисление.
-
Гетероциклические соединения
Характеристика гетероциклических соединений, их биологическое значение, распространение в природе, участие в построении аминокислот и классификация. Строение гемма крови и хлорофилла. Структура фурана, фурфурола, имидазола, тиазола, пирана, пиридина.
-
Гетероциклические соединения
Понятие гетероциклических соединений, их сущность и особенности, основные химические свойства и общая формула. Классификация гетероциклических соединений, разновидности, отличительные черты и способы получения. Реакции электрофильного замещения.
-
Классификация органических соединений. Виды связи. Специфические свойства органических соединени
Казахский Гуманитарно-Юридический Инновационный Университет Кафедра: Информационных технологий и экономики СРСП №1 На тему: «Классификация органических соединений. Виды связи. Специфические свойства органических соединений. Структурные формулы. Изомерия.»
-
Основные понятия координационной химии
Координационная связь (связь металл-лиганд). Октаэдрический комплекс. Идея "оптимального" взаимодействия между реагентами и катализатором. Гетерогенный катализ. Интермедиат в каталитическом процессе. Комплексы, их классификация, понятия и определения.
-
Циклопарафины. Состав, строение, изомерия
Циклоалканы как ненасыщенные углеводороды, в молекулах которых имеется замкнутое кольцо из углеродных атомов, анализ их основных физических и химических свойств, общая формула и реакционная способность. Цис-транс-изомерия в циклических соединениях.
-
Ароматические гетероциклические соединения
Понятие и сущность соединений. Описание и характеристика ароматических гетероциклических соединений. Получение и образование соединений. Реакции по атомному азоту, электрофильного замечания и нуклеинового замещения. Окисление и восстановление. Хинолин.
-
Полимеры: общий обзор класса
Школа №41 Тема: Полимеры Выполнила: Гилева Мария класс 11 "В" 2000/2001 учебный год Полимеры - высокомолекулярные соединения, вещества с большой молекулярной массой (от нескольких тысяч до нескольких миллионов), молекулы которых (макромолекулы) состоят из большого числа повторяющихся группировок (мономерных звеньев).
-
Фармацевтический анализ производных фенотиазина
Фенотиазины как исторически первый класс антипсихотических средств, по своей химической структуре представляющие трициклические молекулы, их классификация и типы. Связь "структура-действие". Фармацевтический анализ фенотиазина и его производных.
-
Фуран. Тиофен. Пиррол
Понятие и характеристика таких соединений как: фуран, тиофен, пиррол и др., их описание и характеристика. Свойства химических соединений и методика их получения. Кислотно-основные свойства. Реакции электрофильного замещения. Восстановление соединений.