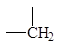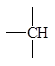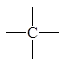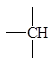Название: Прогнозирование критических свойств веществ и критериев подобия
Вид работы: реферат
Рубрика: Химия
Размер файла: 92.73 Kb
Скачать файл: referat.me-370098.docx
Краткое описание работы: ПРОГНОЗИРОВАНИЕ КРИТИЧЕСКИХ СВОЙСТВ ВЕЩЕСТВ И КРИТЕРИЕВ ПОДОБИЯ Критические (жидкость-пар) температура ( ) и давление ( ) являются важнейшими свойствами, которые положены в основу современных методов прогнозирования, основанных на принципе соответственных состояний. Качество сведений о критических свойствах во многом определяет результативность прогноза свойств веществ, зависящих от межмолекулярных взаимодействий.
Прогнозирование критических свойств веществ и критериев подобия
ПРОГНОЗИРОВАНИЕ КРИТИЧЕСКИХ СВОЙСТВ ВЕЩЕСТВ И КРИТЕРИЕВ ПОДОБИЯ
Критические (жидкость-пар) температура (Tc ) и давление (Рс ) являются важнейшими свойствами, которые положены в основу современных методов прогнозирования, основанных на принципе соответственных состояний. Качество сведений о критических свойствах во многом определяет результативность прогноза свойств веществ, зависящих от межмолекулярных взаимодействий.
Критическая температура и критическое давление с высокой точностью определяются экспериментально для тех веществ, которые термически стабильны при критических температурах. Для таких веществ на кафедре ТО и НХС СамГТУ А.Г.Назмутдиновым реализован метод экспериментального определения критических температур. Прецизионное определение критического объема затруднено, так как ничтожное изменение температуры и давления в критической точке влекут за собой значительные изменения объема. Несмотря на то, что экспериментальные методы совершенствуются, надежные сведения о критических свойствах веществ получены в основном только для соединений с относительно простым строением молекул. По мере увеличения сложности молекулярной структуры экспериментальных данных становится все меньше, а для многих веществ, приобретающих все больший практический интерес, такие сведения совершенно отсутствуют.
Таблица 5.1
Результаты прогнозирования критической (жидкость-пар) температуры алканов различными методами
| Вещество |
Tb , K эксп. |
Tc , K эксп. |
( 1-2 χ ) - D |
Tc , (расч.)- Tc , (эксп.) для методов* |
||||||
| I |
II |
III |
IV |
V |
VI |
VII |
||||
| Пропан |
231,10 |
370,02 |
2,1213 |
0,2 |
-0,4 |
0,7 |
-1,6 |
-21,5 |
-0,9 |
-0,4 |
| Бутан |
272,65 |
425,18 |
2,9142 |
-0,2 |
0,2 |
0,4 |
-1,4 |
-2,1 |
-1,5 |
-0,5 |
| Пентан |
309,22 |
469,81 |
3,7678 |
-0,4 |
-0,1 |
0,8 |
-0,4 |
6,0 |
-0,7 |
0,1 |
| Гексан |
341,89 |
507,68 |
4,6213 |
-0,5 |
-0,6 |
0,6 |
0,0 |
8,9 |
-0,1 |
0,2 |
| Гептан |
371,57 |
540,25 |
5,4749 |
0,0 |
-0,5 |
0,4 |
0,4 |
9,7 |
0,9 |
0,3 |
| Октан |
398,82 |
569,37 |
6,3284 |
0,4 |
-0,2 |
-0,2 |
0,4 |
9,1 |
1,8 |
0,2 |
| Нонан |
423,97 |
594,64 |
7,1820 |
0,6 |
-0,2 |
-1,3 |
-0,1 |
7,6 |
2,2 |
-0,4 |
| Декан |
447,27 |
617,70 |
8,0355 |
0,9 |
0,1 |
-2,4 |
-0,6 |
6,1 |
2,6 |
-0,9 |
| Ундекан |
469,04 |
639,00 |
8,8891 |
0,6 |
-0,2 |
-4,0 |
-1,8 |
3,9 |
2,4 |
-1,8 |
| Додекан |
489,43 |
658,00 |
9,7426 |
0,9 |
0,1 |
-4,9 |
-2,3 |
2,2 |
2,6 |
-2,1 |
| Тридекан |
508,58 |
675,00 |
10,596 |
1,6 |
0,8 |
-5,3 |
-2,4 |
1,0 |
3,1 |
-1,7 |
| Тетрадекан |
526,67 |
693,00 |
11,450 |
-0,2 |
-0,9 |
-7,8 |
-4,6 |
-2,5 |
1,1 |
-3,4 |
| Пентадекан |
543,83 |
708,00 |
12,303 |
-0,1 |
-0,8 |
-8,1 |
-4,7 |
-4,0 |
0,9 |
-2,8 |
| Гексадекан |
559,98 |
723,00 |
13,157 |
-1,2 |
-1,9 |
-9,3 |
-5,8 |
-6,5 |
-0,5 |
-3,1 |
| Гептадекан |
574,56 |
736,00 |
14,010 |
-2,3 |
-2,9 |
-10,0 |
-6,5 |
-7,8 |
-2,0 |
-2,8 |
| Октадекан |
588,3 |
747,00 |
14,864 |
-2,3 |
-2,9 |
-9,2 |
-5,8 |
-7,7 |
-2,5 |
-1,0 |
| Нонадекан |
602,34 |
755 |
15,718 |
1,1 |
0,5 |
-4,5 |
-1,2 |
-5,4 |
0,5 |
4,9 |
| Эйкозан |
616,84 |
768 |
16,571 |
0,1 |
-0,5 |
-3,6 |
-0,6 |
-8,6 |
-0,9 |
7,0 |
| Генейкозан |
629,65 |
778 |
17,425 |
0,1 |
-0,5 |
-1,2 |
1,5 |
-9,3 |
-1,4 |
10,7 |
| Докозан |
641,75 |
786 |
18,278 |
1,3 |
0,7 |
3,0 |
5,3 |
-8,4 |
-0,7 |
16,3 |
| 2-Метилпентан |
333,39 |
497,50 |
4,4415 |
-0,6 |
0,1 |
2,7 |
1,7 |
-0,9 |
-2,5 |
0,9 |
| 3-Метилпентан |
336,40 |
504,40 |
4,2076 |
0,1 |
0,2 |
0,4 |
-0,7 |
-1,6 |
-4,9 |
2,3 |
| 2,3-Диметилбутан |
331,13 |
499,98 |
3,9135 |
0,7 |
-0,2 |
1,6 |
0,1 |
-12,1 |
-8,3 |
-0,5 |
| 2,2-Диметилбутан |
322,88 |
488,78 |
3,7727 |
1,3 |
0,6 |
2,7 |
3,1 |
-3,5 |
-9,4 |
0,5 |
| 2-Метилгексан |
363,20 |
530,36 |
5,2950 |
-0,2 |
0,1 |
2,5 |
2,2 |
3,1 |
-1,5 |
1,1 |
| 3-Метилгексан |
365,00 |
535,26 |
5,1068 |
-0,1 |
0,2 |
0,3 |
-0,1 |
3,2 |
-3,7 |
2,5 |
| 3-Этилпентан |
366,62 |
540,64 |
4,9147 |
-0,7 |
-0,4 |
-2,7 |
-3,1 |
-2,2 |
-6,7 |
3,4 |
| 2,3-Диметилпентан |
362,93 |
537,36 |
4,6379 |
0,9 |
0,4 |
-0,2 |
-1,0 |
-5,9 |
-8,8 |
2,0 |
| 2,4-Диметилпентан |
353,65 |
519,79 |
5,0166 |
-0,2 |
-0,3 |
3,7 |
2,9 |
-4,5 |
-4,8 |
0,8 |
| 2,2-Диметилпентан |
352,35 |
520,50 |
4,7061 |
1,1 |
1,1 |
3,4 |
4,5 |
3,7 |
-7,4 |
1,5 |
| 3,3-Диметилпентан |
359,21 |
536,41 |
4,3581 |
0,2 |
-0,1 |
-2,3 |
-1,2 |
-13,3 |
-0,3 |
|
| 2,2,3-Триметилпентан |
354,02 |
531,12 |
4,1401 |
0,8 |
-0,2 |
0,1 |
0,8 |
0,1 |
-15,6 |
-0,4 |
| 2-Метилгептан |
390,78 |
559,64 |
6,1486 |
0,2 |
0,3 |
1,9 |
2,2 |
4,3 |
-0,5 |
0,9 |
| 3-Метилгептан |
392,07 |
563,67 |
5,9604 |
0,2 |
0,3 |
-0,3 |
0,0 |
4,5 |
-2,7 |
2,3 |
| 4-Метилгептан |
390,87 |
561,74 |
6,0061 |
-0,1 |
0,5 |
-0,1 |
0,2 |
6,5 |
-2,5 |
2,5 |
| 3-Этилгексан |
391,69 |
565,49 |
5,8139 |
-0,4 |
0,1 |
-0,1 |
-2,4 |
2,7 |
-5,1 |
3,7 |
| 2,3-Диметилгексан |
388,78 |
563,49 |
5,5371 |
0,8 |
0,7 |
-0,3 |
-0,4 |
-1,2 |
-7,3 |
2,2 |
| 2,4-Диметилгексан |
382,57 |
553,52 |
5,6917 |
-0,1 |
-0,4 |
0,71 |
0,6 |
-0,1 |
-6,2 |
1,9 |
| 2,5-Диметилгексан |
382,29 |
550,06 |
5,9687 |
-0,3 |
0,5 |
3,8 |
3,7 |
-1,3 |
-3,1 |
1,4 |
| 3,4-Диметилгексан |
390,91 |
568,85 |
5,2917 |
1,8 |
0,8 |
-2,5 |
-2,7 |
-2,3 |
-9,6 |
3,8 |
| 3-Этил-2-метил-пентан |
388,79 |
567,09 |
5,3375 |
-0,2 |
-0,5 |
-3,8 |
-4,0 |
-4,8 |
-10,8 |
2,5 |
| 2,3,4-Триметилпентан |
386,62 |
566,41 |
5,1334 |
0,0 |
-0,1 |
5,8 |
-2,2 |
-10,2 |
-13,3 |
0,8 |
| 2,2-Диметилгексан |
379,99 |
549,87 |
5,5597 |
1,4 |
1,1 |
2,9 |
4,7 |
6,3 |
-6,2 |
1,5 |
| 3,3-Диметилгексан |
385,12 |
562,02 |
5,2915 |
0,2 |
0,6 |
-1,8 |
-0,0 |
-1,6 |
-11,0 |
0,6 |
| 3-Метил-3-этил-пентан |
391,42 |
576,58 |
4,9710 |
-0,9 |
-0,3 |
-7,2 |
-5,4 |
-16,1 |
-16,6 |
-0,7 |
| 2,2,3-Триметилпентан |
383,00 |
563,50 |
4,8657 |
1,3 |
0,8 |
-1,6 |
-0,2 |
-1,4 |
-15,5 |
2,2 |
| 2,2,4-Триметилпентан |
372,40 |
543,96 |
5,3301 |
-0,8 |
-1,0 |
2,4 |
3,8 |
-3,6 |
-11,2 |
-0,5 |
| 2,3,3-Триметилпентан |
387,89 |
573,56 |
4,7424 |
0,2 |
-0,1 |
-4,5 |
-3,1 |
-11,6 |
-18,6 |
-0,5 |
| 2,2,3,3-Тетраметил-бутан |
379,44 |
567,80 |
4,3966 |
-1,6 |
-2,0 |
-3,7 |
-0,6 |
12,5 |
-24,9 |
-2,8 |
| 2-Метилоктан |
416,44 |
587,00 |
7,0021 |
-0,4 |
-0,5 |
0,0 |
0,9 |
3,1 |
-0,8 |
-0,4 |
| 2,6-Диметилгептан |
408,37 |
577,92 |
6,8223 |
-0,7 |
-0,1 |
2,1 |
2,6 |
-0,9 |
-3,1 |
0,2 |
| 2,2-Диметилгептан |
405,97 |
577,80 |
6,4132 |
0,6 |
0,1 |
1,0 |
3,3 |
5,6 |
-6,3 |
0,1 |
| 2,2,3-Триметилгексан |
406,76 |
588,02 |
5,7869 |
-0,8 |
-0,7 |
-3,5 |
-1,5 |
0,5 |
-15,4 |
0,6 |
| 2,2,4-Триметилгексан |
399,70 |
573,62 |
6,0019 |
0,7 |
0,4 |
0,7 |
2,7 |
14,9 |
-11,0 |
2,0 |
| 2,2,5-Триметилгексан |
397,24 |
568,02 |
6,2334 |
0,1 |
0,3 |
2,8 |
4,8 |
1,8 |
-8,8 |
0,5 |
| 2,4,4-Триметилгексан |
403,81 |
581,62 |
5,9375 |
-0,6 |
0,0 |
-1,4 |
0,6 |
-7,8 |
-13,2 |
0,0 |
| 3,3-Диэтилпентан |
419,34 |
610,03 |
5,6115 |
-2,3 |
-0,6 |
-12,2 |
-9,8 |
-23,0 |
-19,7 |
-1,3 |
| 2,2,3,3-Тетраметил-пентан |
413,44 |
607,63 |
5,0363 |
-0,5 |
0,4 |
-6,2 |
-2,4 |
0,0 |
-25,6 |
-0,7 |
| 2,2,3,4- Тетраметил-пентан |
406,18 |
592,73 |
5,4162 |
-1,5 |
-0,9 |
-4,3 |
-2,7 |
-9,5 |
-21,0 |
-0,2 |
| 2,2,4,4- Тетраметил-пентан |
395,44 |
574,72 |
5,6625 |
-2,3 |
-2,3 |
-1,8 |
4,1 |
-12,4 |
-18,1 |
-2,4 |
| 2,3,3,4- Тетраметил-пентан |
414,71 |
607,10 |
5,2138 |
-0,6 |
0,5 |
-6,3 |
-4,6 |
-17,5 |
-23,3 |
-0,4 |
| 2,2,5-Триметилгептан |
423,90 |
598,90 |
6,8987 |
-0,6 |
-0,7 |
-1,4 |
1,1 |
-0,2 |
-11,1 |
0,3 |
| 3,3,5- Триметилгептан |
428,83 |
609,60 |
6,6028 |
-0,9 |
-0,6 |
-5,1 |
-2,6 |
-7,5 |
-15,0 |
0,3 |
| 2,2,3,3-Тетраметил-гексан |
433,46 |
623,00 |
5,9594 |
0,4 |
1,8 |
-5,0 |
-0,8 |
5,5 |
-21,9 |
0,7 |
| 2,2,5,5- Тетраметил-гексан |
410,61 |
581,40 |
6,4980 |
2,7 |
2,3 |
4,0 |
8,0 |
7,3 |
-12,0 |
1,7 |
| 2,2,4,4,6,8,8-Гепта-метилнонан |
520,25 |
693,00 |
10,339 |
1,5 |
3,2 |
-4,4 |
2,6 |
-10,8 |
-21,8 |
0,5 |
| Среднее абсолютное отклонение, % отн. |
0,13 |
0,11 |
0,51 |
0,41 |
1,09 |
1,35 |
0,29 |
|||
| Среднее абсолютное отклонение, К |
0,75 |
0,67 |
3,12 |
2,43 |
6,24 |
7,82 |
1,82 |
|||
* Методы: I - по 1-2 χ , II - по связям, III - Лидерсена, IV - Джобака, V - Константину-Гани, VI - Вильсона-Джасперсона, VII - Марреро-Пардилло.
Накопленные к настоящему времени значения критических свойств веществ заимствованы нами из [5, 6, 20, 33-42] и обобщены в Приложении 1. Очевидно, что база экспериментальных данных по критическим свойствам органических веществ не столь обширна, как того требует практика, и пополняется крайне медленно по вполне объективным причинам. В подобной ситуации можно рассчитывать на успех, только располагая надежными методами прогнозирования критических свойств. Уровень требований к качеству последних весьма высок. Так, например, погрешность прогноза критических температур, составляющая всего 1% отн., или критического давления - 10% отн., приводит к ошибке прогнозирования давлений насыщенного пара, превосходящей 15-20% отн. для диапазонов давлений, представляющих наибольший практический интерес. При неблагоприятном наложении указанных погрешностей в критических свойствах ошибка в Р-Т данных возрастает как минимум вдвое.
Выполненный нами анализ разработанных к настоящему времени методов прогнозирования критических свойств показал, что столь жесткие требования к качеству прогноза не обеспечиваются ни одним из методов. В табл. 5.1. приведена иллюстрация сказанного на примере критических температур алканов, вычисленных методами Лидерсена, Джобака, Константину-Гани, Вильсона-Джасперсона и Марреро-Пардилло [5-6]. Комментарии, как нам представляется, излишни. Аналогичный результат получен также для соединений следующих классов: алкилфенолов, алкилпиридинов, алкенов, кетонов, простых и сложных эфиров, спиртов и карбоновых кислот. Таким образом, вопросы совершенствования методов прогнозирования критических свойств сохраняют особую значимость. Полагаем, что материал, приведенный в данном пособии, будет тому способствовать. В настоящее время предложены различные подходы к прогнозированию критических температур и давлений. Значительная часть методов обобщена Полингом, Праусницем и О'Коннелом в [5] и широко апробирована нами в приложении к различным классам органических веществ. Для алканов результаты такой апробации только что приведены. В пособии рассмотрены некоторые методы массовых расчетов критических свойств, либо обладающие универсальностью при удовлетворительном качестве прогноза, либо позволяющие производить оценки критических свойств с погрешностью, близкой к экспериментальной.
Прогнозирование критической температуры
Сложность прогнозирования критической (жидкость-пар) температуры органических веществ состоит в том, что Тс изменяются нелинейно с изменением числа углеродных атомов в молекуле даже в отдельно взятой гомологической группе (рис. 5.1.). Аддитивные методы для таких свойств оказываются неэффективными, поскольку нелинейность свойства сохраняется для значительного количества соединений при переходе от низших представителей гомологических групп к высшим. Это не позволит принять некоторое постоянное значение даже для парциального вклада, характеризующего гомологическую разность, т.е. вклад на СН2 группу.
Для таких свойств широко используются аддитивно-корреляционные методы, в которых вид корреляции ответственен за изменение свойства в гомологической группе, а аддитивная составляющая свойства передает его связь со строением молекул. Рассчитывать на успех в применении этих методов возможно только в случае одинаковых соотношений типа “значение свойства - количество углеродных атомов в любой гомологической группе”. Из рис. 5.1 следует, что для критических температур это условие также не выполняется.
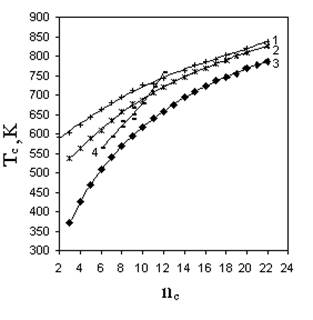
Р и с. 5.1. Зависимость критической температуры
от числа углеродных атомов в молекуле:
1 - н-монокарбоновые кислоты; 2 – н-спирты;
3 – н-алканы; 4 – бензол - метилбензолы
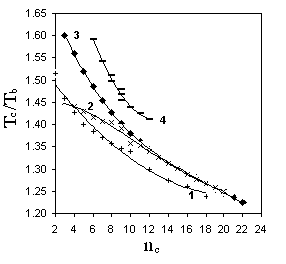
Р и с. 5.2. Зависимость Tc/Tb от числа
углеродных атомов в молекуле:
1 - н-монокарбоновые кислоты;
2 – н-спирты; 3 – н-алканы;
4 – бензол - метилбензолы
Приблизиться к решению проблемы удалось, используя аддитивно-корреляционные методы с дополнительной опорой на родственное с критической температурой свойство вещества. В качестве такого свойства наилучшим образом выступает нормальная температура кипения (Tb ). С одной стороны, предельно близка природа этих свойств, с другой - Tb наиболее полно по сравнению с другими физико-химическими свойствами подкреплены справочными данными. Именно Tb является опорным свойством в большинстве методов прогнозирования критических температур.
Иллюстрацией того, что указанный прием позволяет несколько упростить задачу прогнозирования T с , является рис. 5.2. Однако наряду с этим из рис. 5.2 следует, что использование Tb в качестве опорного свойства не гарантирует успеха при прогнозировании T с на основе общих универсальных корреляций для соединений любых классов. Примером тому служит совершенно иной по сравнению с соединениями прочих приведенных на рис. 5.2 классов вид корреляции для первичных спиртов С3 -С10 .
Метод Лидерсена
При выполнении массовых расчетов критических температур широко применяется метод Лидерсена [6]. В качестве опорного свойства используется нормальная температура кипения (Tb ) в градусах Кельвина. Корреляция для критической температуры имеет вид
![]() , (5.1)
, (5.1)
где åDT - сумма парциальных вкладов в критическую температуру, значения которых приведены в табл. 5.2.
Метод достаточно прост в использовании, поэтому мы не сопровождаем его примерами, однако считаем целесообразным предупредить о довольно часто встречающихся в нашей практике ошибках. Следует внимательно производить отбор парциальных вкладов из табл. 5.2, поскольку для нециклических и циклических фрагментов молекул значения вкладов могут быть различны при идентичной символике для них.
Таблица 5.2
Парциальные вклады для расчета критических свойств методом Лидерсена 1)
| DT |
DP |
DV |
||
| Ациклические составляющие |
||||
|
|
0,020 |
0,227 |
55 |
|
|
|
0,020 |
0,227 |
55 |
|
|
|
0,012 |
0,210 |
51 |
|
|
|
0,00 |
0,210 |
41 |
|
|
|
0,018 |
0,198 |
45 |
|
|
|
0,018 |
0,198 |
45 |
|
|
|
0,0 |
0,198 |
36 |
|
|
|
0,0 |
0,198 |
36 |
|
|
|
0,005 |
0,153 |
(36) |
|
|
|
0,005 |
0,153 |
(36) |
|
| Циклические составляющие |
||||
|
|
0,013 |
0,184 |
44,5 |
|
|
|
0,012 |
0,192 |
46 |
|
|
|
(-0,007) |
(0,154) |
(31) |
|
|
|
0,011 |
0,154 |
37 |
|
|
|
0,011 |
0,154 |
36 |
|
|
|
0,011 |
0,154 |
36 |
|
| Составляющие для групп, содержащих галогены |
||||
|
|
0,018 |
0,224 |
18 |
|
|
|
0,017 |
0,320 |
49 |
|
|
|
0,010 |
(0,50) |
(70) |
|
|
|
0,012 |
(0,83) |
(95) |
|
| Составляющие для групп, содержащих кислород |
||||
|
|
0,082 |
0,06 |
(18) |
|
|
|
0,031 |
(-0,02) |
(3) |
|
|
|
0,021 |
0,16 |
20 |
|
|
|
(0,014) |
(0,12) |
(8) |
|
|
|
0,040 |
0,29 |
60 |
|
|
|
(0,033) |
(0,2) |
(50) |
|
|
|
0,048 |
0,33 |
73 |
|
|
|
0,085 |
(0,4) |
80 |
|
|
|
0,047 |
0,47 |
80 |
|
|
|
(0,02) |
(0,12) |
(11) |
|
| Составляющие для групп, содержащих азот |
||||
|
|
0,031 |
0,095 |
28 |
|
|
|
0,031 |
0,135 |
(37) |
|
|
|
(0,024) |
(0,09) |
(27) |
|
|
|
0,014 |
0,17 |
(42) |
|
|
|
(0,007) |
(0,13) |
(32) |
|
|
|
(0,060) |
(0,36) |
(80) |
|
|
|
(0,055) |
(0,42) |
(78) |
|
| Составляющие для групп, содержащих серу |
||||
|
|
0,015 |
0,27 |
55 |
|
|
|
0,015 |
0,27 |
55 |
|
|
|
(0,008) |
(0,24) |
(45) |
|
|
|
(0,003) |
(0,24) |
(47) |
|
| Прочие составляющие |
||||
|
|
0,03 |
(0,54) |
||
|
|
(0,03) |
|||
Примечание. 1)
Составляющие для водорода в расчет не принимаются. Атомы и группы соединены указанными свободными связями с неводородными атомами. Значения, заключенные в скобки, рассчитаны по ограниченному числу экспериментальных данных. На основании экспериментальных данных по давлению паров и расчетов по методу Фиштайна установлено, что циклическая составляющая ![]() , общая для двух насыщенных колец, имеет значение DT
=0,064.
, общая для двух насыщенных колец, имеет значение DT
=0,064.
Лидерсен проверил свой метод для 244-х веществ различных классов и нашел, что только в 27 случаях ошибка превышала 2% отн. Он объяснил эти отклонения недостаточной надежностью экспериментальных данных.
По оценкам Рида и Шервуда [20] метод Лидерсена дает несколько заниженные значения вычисленных Tc (на 1-2 % отн.) для алканов и сложных эфиров с большой молекулярной массой. Опыт нашей работы с этим методом позволяет заключить, что отклонения носят систематический характер, свойственный соединениям всех классов. Источником отклонений служит достаточно жесткая параболическая зависимость, использованная Лидерсеном для описания связи критической температуры с нормальной температурой кипения веществ и строением их молекул.
Похожие работы
-
Прогнозирование энтальпии образования при нормальных и повышенных давлениях
Прогнозирование органических соединений При прогнозировании энтальпий образования органических веществ, находящихся при давлении 1 атм и температуре выше 298 К, используются:
-
Плотность жидкости при нормальной температуре кипения
Аддитивный метод Шредера При изучении свойств органических жидкостей Шредером было сформулировано правило, в соответствии с которым при прогнозировании мольного объема чистой жидкости при нормальной температуре кипения следует сосчитать число атомов углерода, водорода, кислорода и азота в молекуле, добавить по единице на каждую двойную связь и сумму умножить на семь.
-
Теплоемкость органических веществ и ее прогнозирование методом Бенсона и при повышенном давлении
Теплоемкость Теплоемкость есть свойство вещества, характеризующее отношение количества тепла, сообщенного этому веществу, к вызванному им изменению температуры. Согласно более строгому определению, теплоемкость - термодинамическая величина, определяемая выражением
-
Энтропия органических веществ при нормальных и повышенных давлениях
Прогнозирование энтропий органических соединений при повышенной температуре При прогнозировании энтропий органических веществ, находящихся при давлении 1 атм и температуре, отличающейся от 298 К, используются:
-
Прогнозирование критической температуры. Алканы и алкены
Критическая температура изменяется нелинейно с изменением числа углеродных атомов в молекуле во всех гомологических группах. При расчете критической температуры для алканов и алкенов используют индексы молекулярной связности Рандича и метод Джобака.
-
Прогнозирование критического давления. Основные методы прогнозирования
Критическое давление его понятие, сущность и особенности. Прогнозирование критического давления. Зависимость критического давления от числа углеродных атомов в молекуле. Методы Лидерсана, Джобака и метод основанный на индексах молекулярной связности.
-
Химические методы анализа
Понятие и назначение химических методов анализа проб, порядок их проведения и оценка эффективности. Классификация и разновидности данных методов, типы проводимых химических реакций. Прогнозирование и расчет физико-химических свойств разных материалов.
-
P-V-T соотношения: реальный газ и идеальный газ
Уравнение механического и термодинамического состояний вещества, исследование количественных соотношений между давлением, объемом и температурой (P-V-T). Идеальный газ. Реальное и критическое состояния вещества. Аналитические уравнения состояния.
-
Критический объем и плотность веществ их прогнозирование
ПРОГНОЗИРОВАНИЕ КРИТИЧЕСКОГО ОБЪЕМА Для массовых расчетов может быть рекомендован метод Лидерсена, возможности и точность которого, однако, не следует переоценивать. По методу Лидерсена критический объем рассчитывается с использованием корреляции:
-
Понятие давления паров и теплоты
Давление паров, теплоты и парообразования чистых жидкостей. Общие сведенья по давлению паров. Корреляция Антуана для давления паров. Корреляция Кокса-Антуана для давления паров. Корреляции, основанные на использовании принципа соответственных состояний.