Название: Плотность жидкости при нормальной температуре кипения
Вид работы: реферат
Рубрика: Химия
Размер файла: 156.75 Kb
Скачать файл: referat.me-370225.docx
Краткое описание работы: Аддитивный метод Шредера При изучении свойств органических жидкостей Шредером было сформулировано правило, в соответствии с которым при прогнозировании мольного объема чистой жидкости при нормальной температуре кипения следует сосчитать число атомов углерода, водорода, кислорода и азота в молекуле, добавить по единице на каждую двойную связь и сумму умножить на семь.
Плотность жидкости при нормальной температуре кипения
Аддитивный метод Шредера
При изучении свойств органических жидкостей Шредером было сформулировано правило, в соответствии с которым при прогнозировании мольного объема чистой жидкости при нормальной температуре кипения следует сосчитать число атомов углерода, водорода, кислорода и азота в молекуле, добавить по единице на каждую двойную связь и сумму умножить на семь. При этом получаем мольный объем жидкости в см3 /моль. Правило Шредера дает удивительно хорошие результаты для нормальных жидкостей - погрешность, как правило, не превышает 3-4% тон. Плотности сильно ассоциированных жидкостей прогнозируются с меньшей точностью. В дальнейшем аддитивный метод Шредера модифицировался самим автором и другими учеными. В табл. 6.5 приведены значения групповых вкладов в последней редакции Шредера и Ле Ба.
Таблица 6.5
Аддитивные составляющие для расчета молярных объемов Vb
органических веществ
| Тип атома, группы, связи | Составляющая, см3 /моль | |
| Шредер | Ле Ба | |
| Углерод | 7 | 14,8 |
| Водород | 7 | 3,7 |
| Кислород (за исключением приведенных ниже случаев): | 7 | 7,4 |
| в метиловых сложных и простых эфирах | – | 9,1 |
| в этиловых сложных и простых эфирах | – | 9,9 |
| в высших сложных и простых эфирах | – | 11,0 |
| в кислотах | – | 12,0 |
| Тип атома, группы, связи | Составляющая, см3 /моль | |
| Шредер | Ле Ба | |
| соединенный с S, P, N | – | 8,3 |
| Азот: | 7 | – |
| с двойной связью | – | 15,6 |
| в первичных аминах | – | 10,5 |
| во вторичных аминах | – | 12,0 |
| Бром | 31,5 | 27 |
| Хлор | 24,5 | 24,6 |
| Фтор | 10,5 | 8,7 |
| Иод | 38,5 | 37 |
| Сера | 21 | 25,6 |
| Кольцо: | – | |
| трехчленное | -7 | -6,0 |
| четырехчленное | -7 | -8,5 |
| пятичленное | -7 | -11,5 |
| шестичленное | -7 | -15,0 |
| нафталиновое | -7 | -30,0 |
| антраценовое | -7 | -47,5 |
| Двойная связь между атомами углерода | 7 | – |
| Тройная связь между атомами углерода | 14 | – |
Неаддитивный метод Тина и Каллуса
Величина мольного объема жидкости при нормальной температуре кипения представлена в качестве функции критического объема:
![]() ,(6.13)
,(6.13)
где ![]() и
и ![]() выражены в см3
/моль.
выражены в см3
/моль.
Это простое соотношение хорошо прогнозирует ![]() для органических чистых жидкостей, погрешность не превышает 3% отн. при условии, что значения критического объема определены надежно.
для органических чистых жидкостей, погрешность не превышает 3% отн. при условии, что значения критического объема определены надежно.
Рассмотренные выше методы Шредера и Тина-Каллуса не распространяются на всю область насыщенных состояний жидкости. Они приложимы к одной точке в этой области - нормальной температуре кипения. Прогнозирование плотности насыщенной жидкости при любой температуре ниже ![]() может быть выполнено на основе некоторых уравнений состояния вещества, так, например, уравнения Бенедикта-Уэбба-Рубина для углеводородов. Однако целесообразнее использовать для этого специальные эмпирические корреляции, которые относительно просты и в большинстве случаев более точны.
может быть выполнено на основе некоторых уравнений состояния вещества, так, например, уравнения Бенедикта-Уэбба-Рубина для углеводородов. Однако целесообразнее использовать для этого специальные эмпирические корреляции, которые относительно просты и в большинстве случаев более точны.
Практически все корреляционные методы основаны на принципе соответственных состояний и требуют знания плотности насыщенной жидкости хотя бы при одной температуре. Поскольку даже такой минимум информации не всегда доступен, приходится прибегать к оценкам критической плотности вещества по его критическому объему. При отсутствии экспериментальных данных вычисление плотности может быть основано на коэффициенте сжимаемости жидкости при давлении насыщения, что рационально выполнять с использованием таблиц Ли-Кеслера (разд. 4). Ниже рассмотрены оба подхода.
Метод Ганна-Ямады
Метод предназначен для прогнозирования молярного объема ![]() и плотности неполярных или слабополярных жидкостей
и плотности неполярных или слабополярных жидкостей ![]() только на линии насыщения.
Он основан на принципе соответственных состояний. Для прогнозирования необходимо как минимум знать ацентрический фактор и критические температуру и давление. Предложенная авторами корреляция имеет вид
только на линии насыщения.
Он основан на принципе соответственных состояний. Для прогнозирования необходимо как минимум знать ацентрический фактор и критические температуру и давление. Предложенная авторами корреляция имеет вид
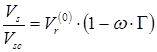 ,(
6.14)
,(
6.14)
где ![]() - безразмерный параметр,
- безразмерный параметр, ![]() - масштабирующий параметр,
- масштабирующий параметр, ![]() - ацентрический фактор.
- ацентрический фактор. ![]() и
и ![]() являются функциями приведенной температуры. Для расчета
являются функциями приведенной температуры. Для расчета ![]() рекомендованы корреляции двух видов:
рекомендованы корреляции двух видов:
при![]()
![]() ;(6.15)
;(6.15)
при![]()
![]() .(6.16)
.(6.16)
Расчет значения ![]() производится по одному уравнению для любой температуры в диапазоне
производится по одному уравнению для любой температуры в диапазоне ![]() :
:
![]() .(6.17)
.(6.17)
При расчете масштабирующего параметра рекомендованы следующие подходы.
Если известен молярный объем насыщенной жидкости ![]() или ее плотность при приведенной температуре
или ее плотность при приведенной температуре ![]() то расчет
то расчет ![]() построен на основе этих сведений:
построен на основе этих сведений:
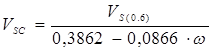 .(6.18)
.(6.18)
Если экспериментальные данные для ![]() отсутствуют, то расчет масштабирующего параметра выполняется по уравнению
отсутствуют, то расчет масштабирующего параметра выполняется по уравнению
![]() .(6.19)
.(6.19)
В большинстве случаев масштабирующий параметр близок по значению к критическому объему ![]() .
.
При наличии экспериментальных сведений о плотности интересующей насыщенной жидкости при некоторой температуре ![]() масштабирующий параметр
масштабирующий параметр ![]() может быть исключен из расчета, и задача сводится к решению уравнения
может быть исключен из расчета, и задача сводится к решению уравнения
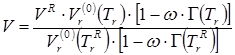 ,
(6.20)
,
(6.20)
где ![]() , а их участие в уравнении следует понимать как температурный уровень, при котором вычисляются
, а их участие в уравнении следует понимать как температурный уровень, при котором вычисляются ![]() и
и ![]() , а не как сомножители.
, а не как сомножители.
Метод Ганна-Ямады считается наиболее точным из имеющихся в настоящее время методов прогнозирования плотности насыщенной жидкостипри Tr < 0,99 . Несмотря на то, что он рекомендован авторами для неполярных или слабо полярных веществ, результативность его зачастую оказывается достаточной и в приложении к полярным жидкостям.
Пример 6.4
Методом Ганна-Ямады рассчитать плотность жидкого изобутилбензола, находящегося на линии насыщения в диапазоне 298-650 К. Критические параметры и ацентрический фактор вещества приведены выше.
Решение
Молярный объем вещества ![]() при избранной температуре вычисляется по уравнению (6.14).
при избранной температуре вычисляется по уравнению (6.14).
Поскольку экспериментальные данные для ![]() отсутствуют, то расчет масштабирующего параметра производим по уравнению (6.19):
отсутствуют, то расчет масштабирующего параметра производим по уравнению (6.19):
![]()
![]() 82,05·650·(0,2920-0,0967·0,378)/31 = 439 см3
/моль.
82,05·650·(0,2920-0,0967·0,378)/31 = 439 см3
/моль.
Результаты расчета плотности приведены в табл.6.6 и на рис. 6.9. Для 298 К имеем:
![]() = 298/650 = 0,458;
= 298/650 = 0,458;
![]() = 0,29607 – 0,09045·0,458 –0,04842·0,4582
= 0,244;
= 0,29607 – 0,09045·0,458 –0,04842·0,4582
= 0,244;
![]() = 0,33593–0,33953·0,458+1,51941·0,4582
+1,11422·0,4584
= 0,354;
= 0,33593–0,33953·0,458+1,51941·0,4582
+1,11422·0,4584
= 0,354;
![]() = 0,354·(1–0,378·0,244)·439 = 140,9 см3
/моль;
= 0,354·(1–0,378·0,244)·439 = 140,9 см3
/моль;
![]() = 134,222/140,9 = 0,952 г/см3
.
= 134,222/140,9 = 0,952 г/см3
.
Метод Йена и Вудса
Метод предназначен для прогнозирования плотностей жидкостей при любых давлениях. В приложении к плотности насыщенной жидкости метод заключается в следующем. Приведенная плотность жидкости, находящейся на линии насыщения, коррелирована с приведенной температурой:
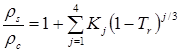 ,(6.21)
,(6.21)
где![]() - мольная плотность насыщенной жидкости,
- мольная плотность насыщенной жидкости, ![]() - критическая плотность вещества,
- критическая плотность вещества, ![]() - приведенная температура.
- приведенная температура.
Коэффициенты ![]() являются функциями критического коэффициента сжимаемости и вычисляются по уравнениям
являются функциями критического коэффициента сжимаемости и вычисляются по уравнениям
![]() ;(6.22)
;(6.22)
![]() при
при ![]() ;(6.23)
;(6.23)
![]() при
при
![]() ;(6.24)
;(6.24)
![]() ;(6.25)
;(6.25)
![]() .(6.26)
.(6.26)
Пример 6.5
Методом Йена и Вудса рассчитать плотность жидкого изобутилбензола, находящегося на линии насыщения в диапазоне 298-650 К. Критический коэффициент сжимаемости изобутилбензола равен 0,28, критический объем составляет 480 см3 /моль.
Решение
1. Вычисляем значения коэффициентов Kj :
![]() ;
;
![]() ;
;
![]() ;
;
![]() .
.
2. Критическая плотность изобутилбензола:
![]() г/см3
.
г/см3
.
3. Рассчитываем плотность жидкого изобутилбензола, находящегося на линии насыщения. Для 298 К имеем
![]() =0,8056 г/см3
.
=0,8056 г/см3
.
Фрагмент результатов расчета при других температурах приведен в табл. 6.6., на рис. 6.9. дается сопоставление их с полученными методом Ганна-Ямады и другими методами.
Метод Чью-Праусница
Метод предназначен для прогнозирования плотности жидкости при любых давлениях . В приложении к жидкому состоянию на линии насыщения метод заключается в следующем. Отношение критической плотности c к плотности насыщенной жидкости s коррелировано с приведенной температурой и ацентрическим фактором:
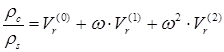 .
.
Для расчета ![]() предложены следующие эмпирические уравнения:
предложены следующие эмпирические уравнения:
![]()
![]() ;(6.27)
;(6.27)
![]()
![]() ;(6.28)
;(6.28)
![]()
![]() (6.29)
(6.29)
Пример 6.6
Методом Чью и Праусница рассчитать плотность жидкого изобутилбензола, находящегося на линии насыщения, в диапазоне 298-650 К. Критический объем составляет 480 см3 /моль.
Решение
1. Вычисляем значения функций ![]() . Для 298 К имеем
. Для 298 К имеем
![]()
![]() ;
;
![]()
![]() ;
;
![]()
![]() .
.
2. Вычисляем критическую плотность
![]() г/см3
.
г/см3
.
3. Рассчитываем плотность изобутилбензола при 298 К:
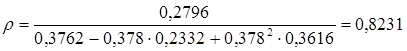
![]() г/см3
.
г/см3
.
Результаты расчета плотности насыщенной жидкости при других температурах приведены в табл. 6.6. и сопоставлены на рис. 6.9. с данными, полученными методами Ганна-Ямады и Йена-Вудса.
Таблица 6.6
Плотность жидкого изобутилбензола (г/см3 ) на линии насыщения,
вычисленная методами Ганна-Ямады (
![]() ), Йена-Вудса (
), Йена-Вудса (
![]() )
)
и Чью-Праусница (
![]() )
)
| Т , К | V | |||||||||
| 323 | 0,497 | 0,239 | 0,362 | 144,5 | 0,929 | 0,789 | 0,3760 | -0,1921 | 0,2659 | 0,8189 |
| 373 | 0,574 | 0,228 | 0,380 | 152,3 | 0,882 | 0,753 | 0,3834 | -0,1271 | 0,1062 | 0,7976 |
| 473 | 0,728 | 0,205 | 0,426 | 172,4 | 0,779 | 0,671 | 0,4238 | -0,0408 | -0,1195 | 0,7145 |
| 573 | 0,882 | 0,179 | 0,512 | 209,7 | 0,640 | 0,556 | 0,5091 | -0,0094 | -0,2057 | 0,5872 |
| 648 | 0,997 | 0,158 | 0,817 | 337,4 | 0,398 | 0,348 | 0,8333 | -0,2592 | 0,4746 | 0,3481 |
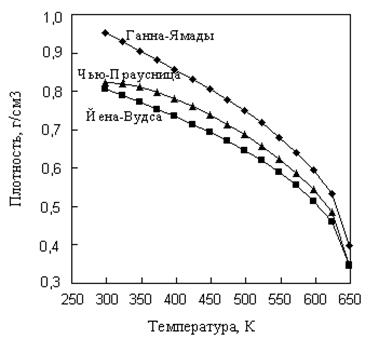
Р и с. 6.9. Зависимость плотности изобутилбензола
от температуры
Из сопоставления следует, что все рассмотренные методы единообразно передают характер изменения плотности изобутилбензола с изменением температуры, наибольшее различие в оценках составляет 18% отн. и относится к 298 К. Причем метод Йена-Вудса дает меньшие значения плотности во всем диапазоне температур. Опыт нашей работы показывает, что из рассмотренных методов предпочтение следует отдавать методам Ганна-Ямады, Чью-Праусница и методу, основанному на коэффициентах сжимаемости, которые вычислены по таблицам Ли-Кеслера или аналитическому уравнению состояния Бенедикта-Уэбба-Рубина.
Плотность ненасыщенной жидкости
При прогнозировании плотности ненасыщенной жидкости в основном используются следующие подходы.
1. В качестве опорного значения плотности принимается плотность насыщенной жидкости при рассматриваемой температуре; вычисляется вклад в плотность, обусловленный изменением давления от уровня давления насыщенного пара до заданного, и рассчитывается плотность жидкости под давлением.
2. По таблицам Ли-Кеслера или по уравнению состояния вещества вычисляется коэффициент сжимаемости при заданных температуре и давлении, после чего вычисляется молярный объем вещества и его плотность.
Похожие работы
-
Алканы
Алканы - это предельные углеводороды, в молекулах которых все атомы связаны одинарными связями. Формула - Физические свойства Температуры плавления и кипения увеличиваются с молекулярной массой и длиной главной углеродной цепи
-
Валентность
http://monax.ru/order/ - рефераты на заказ (более 2300 авторов в 450 городах СНГ). Тема: Валентность Цель: Дать учащимся понятие о валентности как свойстве атомов присоединять определённое число атомов другого элемента, научить их определять валентность элементов по формулам их соединений.
-
Прогнозирование критической температуры. Алканы и алкены
Критическая температура изменяется нелинейно с изменением числа углеродных атомов в молекуле во всех гомологических группах. При расчете критической температуры для алканов и алкенов используют индексы молекулярной связности Рандича и метод Джобака.
-
Прогнозирование критического давления. Основные методы прогнозирования
Критическое давление его понятие, сущность и особенности. Прогнозирование критического давления. Зависимость критического давления от числа углеродных атомов в молекуле. Методы Лидерсана, Джобака и метод основанный на индексах молекулярной связности.
-
Химия
Природный газ одного из месторождений содержит 92% метана, 4% этана, , 1% пропана, 2% углекислого газа и 1% азота (по объему). Какой объем кислорода потребуется для сжигания 200 л этого газа?
-
Теория Бутлерова 2
I. Строение молекулы метана. Молекулярная формула метана CH4. Так как атом углерода имеет большую электроотрицательность (2,5), чем водород (2,1), то в молекуле метана происходит незначительное смещение общих электронных пар в сторону атома углерода.
-
Ациклические непредельные углеводороды (алкены)
Исследование состава и структуры алкенов как ациклических непредельных углеродов, содержащих одну двойную связь С=С. Процесс получения алкенов и свойства цис-транс-изомерии в ряду алкенов. Анализ физических и химических свойств алкенов и их применение.
-
Понятие давления паров и теплоты
Давление паров, теплоты и парообразования чистых жидкостей. Общие сведенья по давлению паров. Корреляция Антуана для давления паров. Корреляция Кокса-Антуана для давления паров. Корреляции, основанные на использовании принципа соответственных состояний.
-
Характеристика ацетиленовых углеводородов
АЦЕТИЛЕНОВЫЕ УГЛЕВОДОРОДЫ (АЛКИНЫ) Ацетиленовыми углеводородами (алкинами) называются непредельные (ненасыщенные) углеводороды, содержащие в молекуле одну тройную связь и имеющие общую формулу CnH2n-2. Родоначальником гомологического ряда этих углеводородов является ацетилен HCCH.
-
Замена углерода
Изучение возможности существования форм жизни, которым свойственны биохимические процессы, полностью отличающиеся от возникших на Земле. Попытки замены углерода в молекулах органических веществ на другие атомы, и воды как растворителя на другие жидкости.