Название: Подготовка и конденсация воды
Вид работы: курсовая работа
Рубрика: Промышленность и производство
Размер файла: 196.71 Kb
Скачать файл: referat.me-302353.docx
Краткое описание работы: Курсовая работа “Подготовка и конденсация воды” Одесса 2010 Введение В настоящее время вода широко используется в различных областях промышленности в качестве теплоносителя и рабочего тела, чему способствует широкое распространение воды в природе и ее особые термодинамические свойства, связанные со строением молекул.
Подготовка и конденсация воды
Курсовая работа
“Подготовка и конденсация воды”
Одесса 2010
Введение
В настоящее время вода широко используется в различных областях промышленности в качестве теплоносителя и рабочего тела, чему способствует широкое распространение воды в природе и ее особые термодинамические свойства, связанные со строением молекул. Полярность молекул воды, характеризуемая дипольным моментом, определяет большую энергию взаимного притяжения молекул воды (ориентационное взаимодействие) при температуре 10…30 С и соответственно большую теплоту фазового перехода при парообразовании, высокую теплоемкость и теплопроводность. Значение диэлектрической постоянной воды, также зависящей от дипольного момента, определяет своеобразие свойств воды как растворителя.
При нагреве воды на поверхностях нагрева образуются твердые отложения накипеобразующих солей. При испарении воды в пар переходят коррозионно-активные газы, которые способствуют разрушению поверхности охлаждения и генерируют новые вещества, образующие отложения из продуктов коррозии.
Надежность работы энергетического оборудования на станции непосредственно связана с качеством подпиточной воды котлов. Правильно рассчитанный, смонтированный и эксплуатируемый комплекс водоподготовки, дополненный химической программой коррекции котловой воды, является необходимым условием долговечной и экономичной работы любого котлоагрегата.
В условиях эксплуатации энергетического оборудования на ТЭС или АЭС при организации водного режима необходимо создавать условия, при которых обеспечиваются минимальные значения скорости коррозии и снижение накипных отложений. Отложения могут образовываться из примесей, поступающих в воду теплоэнергетических установок от внешних и от внутренних источников.
Исходные данные
Исходной водой является вода Бассейны Ингула со следующим химическим составом:
-биогенные компоненты:
![]() =1,66 мг/л;;
=1,66 мг/л;;
NO2+=0,030 мг/л;
NO3+=0,11 мг/л;
Fe=0,11 мг/л;
P=0,060мг/л;
Si=5,9 мг/л;
-окисляемость:
БО=28,4 мгО2/л;
ПО=7,8мгО2/л;
-главные ионы:
HCO3-=294,7 мг/л;
SO42-=67,8 мг/л;
Cl-=55,7 мг/л;
Ca2+=92,3 мг/л;
Mg2+=15,9 мг/л;
Na++K+=38,5мг/л;
-Жо=5,9 мг-экв/л;
Блоки: 210МВт 6шт.
Таблица 1
| Общая концентрация |
Электро провод ность, χ=Сλf мкСм/см |
|||||||||
| Молекуля рная масса "М" |
Эквива лентная масса "Э" |
Обозначения |
Исх. концентрация |
Скорректированная концентрация |
||||||
| [H] мг/кг |
[C]мг-экв/кг |
[H] мг/кг |
[C] мг-экв/кг |
[N] моль/кг |
% |
|||||
| 40,08 |
20,04 |
Ca2+ |
51,8 |
2,585 |
51,8 |
2,585 |
0,0013 |
0,005 |
110,67 |
|
| 24,03 |
12,01 |
Mg2+ |
10,8 |
0,899 |
10,8 |
0,899 |
0,0004 |
0,001 |
40,8 |
|
| 23 |
23 |
Na+ |
6,4 |
0,278 |
11,884 |
0,517 |
0,0005 |
0,001 |
23,84 |
|
| 1 |
1 |
H+ |
||||||||
| Сумма Kt |
3,762 |
4,001 |
||||||||
| 17 |
17 |
OH- |
||||||||
| 61 |
61 |
HCO3- |
199,7 |
3,274 |
199,7 |
3,274 |
0,0033 |
0,020 |
134,18 |
|
| 60 |
30 |
CO32- |
||||||||
| 96 |
48 |
SO42- |
17,3 |
0,360 |
17,3 |
0,360 |
0,0002 |
0,002 |
20,75 |
|
| 35,46 |
35,46 |
Cl- |
13,0 |
0,367 |
13,0 |
0,367 |
0,0004 |
0,001 |
25,78 |
|
| Сумма An |
4,001 |
4,001 |
||||||||
| Обозначения |
Значения |
Обозначения и расчетные формулы |
Значения |
|||||||
| NH4-,мг/л |
0,60 |
моль/л |
0,006 |
|||||||
| NO2-, мг/л |
0,02 |
f’ |
0,921 |
|||||||
| NO3-, мг/л |
0,11 |
f“ |
0,720 |
|||||||
| Fe, мг/л |
0,10 |
CО2ф,моль/л |
0,00002 |
|||||||
| P, мг/л |
0,04 |
СО2р,моль/л |
0,00016 |
|||||||
| Si, мг/л |
0,00 |
рНф |
8,59 |
|||||||
| БО, мгО2/л |
10,7 |
рНр |
7,75 |
|||||||
| ПО, мгО2/л |
4,00 |
Ис |
0,84 |
|||||||
| Жо, мг-экв/л |
3,7 |
Жо-расчетное значение, мг-экв/л |
3,48 |
|||||||
| СС,мг/л |
СС, расчетное значение мг/л |
304,48 |
||||||||
| Электропроводность,Сf,мкСм/см |
356,02 |
|||||||||
Расчёт и корректировка исходного состава воды
Для начала найдём эквивалентные массы ионов:
Э = М/Z,
где М- молярная масса иона;
Z- заряд иона.
Э(Са2+) = 40,08/2 = 20,04 г-экв;
Эквиваленты остальных ионов считаются аналогично.
Расчет начинаем с анионного состава воды:
[С] = [Н]/Э,
где [Н]- концентрация иона, выраженная в мг/л,
Э- эквивалент иона.
С(HCO3-) =3,274мг-экв/кг;
С(SO42-) = 0,360мг-экв/кг;
C(Cl-) = 0,367 мг-экв/кг.
Σ An = 4,001мг-экв/кг.
Рассчитаем катионный состав воды:
С(Са2+) = 2,585мг-экв/кг;
С(Mg2+) = 0,899мг-экв/кг;
С(Na+) = 0,278мг-экв/кг;
Σ Kt = 3,762мг-экв/кг.
Правильность определения концентраций катионов и анионов, т.е. солей, образованных эквивалентным количеством ионов, проверяют на основании закона электронейтральности по уравнению:
Σ Kt=ΣAn.
При несоблюдении этого условия, следует скорректировать состав воды. Это достигается путём добавления натрия Na+.
Т.о. закон электронейтральности соблюдается.
Пересчитаем значения концентраций примесей в другие виды концентраций: [N]= [Н]/(М.1000), моль/л;
Пересчёт остальных концентраций осуществляется аналогично.
[С]= [Н]/104,%
Ионная сила раствора равна полусумме произведений молярных концентраций на квадраты их зарядов.
μ = 0,5 ![]()
Коэффициент активности – функция ионной силы раствора:
lg f' = -0.5Zi2 ![]() ,
,
f = 10![]() ,
,
Концентрация в природных водах недиссоциированных молекул Н2СО3 составляет обычно лишь доли процента от общего количества свободной углекислоты, под которым понимают сумму Н2СО3+ СО2.
Равновесное значение суммы Н2СО3+ СО2, моль/кг
Н2СО3+ СО2 = 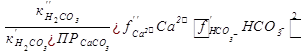 ,
,
и рН – равновесное
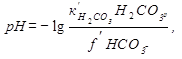
Таблица 2
| Молекуляр- |
Эквивалент- |
Обозначения |
Концентрации после коагуляции |
Электропровод- |
|||
| ная масса "М" |
ная масса "Э" |
[H] мг/кг |
[C] мг-экв/кг |
[N] моль/кг |
% |
ность, мкСм/см |
|
| 40.08 |
20.04 |
Ca2+ |
51.800 |
2.585 |
0.0013 |
0.005 |
109.97 |
| 24.03 |
12.01 |
Mg2+ |
10.800 |
0.899 |
0.0004 |
0.001 |
40.54 |
| 23 |
23 |
Na+ |
11.884 |
0.517 |
0.0005 |
0.001 |
|
| 1 |
1 |
H+ |
|||||
| Сумма Kt |
4.001 |
||||||
| 17 |
17 |
OH- |
|||||
| 61 |
61 |
HCO3- |
169.200 |
2.774 |
0.003 |
0.017 |
113.50 |
| 60 |
30 |
CO32- |
|||||
| 96 |
48 |
SO42- |
41.300 |
0.860 |
0.000 |
0.000 |
49.23 |
| 35.46 |
35.46 |
Cl- |
13.000 |
0.367 |
0.000 |
0.001 |
25.74 |
| Сумма An |
4.001 |
||||||
| Обозначения |
Значения |
Обозначения и расчетные формулы |
Значения |
||||
| NH4+, мг/л |
0.300 |
моль/л |
0.006 |
||||
| NO2-, мг/л |
0.011 |
f' |
0.920 |
||||
| NO3-, мг/л |
0.055 |
f'' |
0.715 |
||||
| Fe, мг/л |
0.030 |
СО2 моль/л |
0.0005 |
||||
| P, мг/л |
0.022 |
pH |
7.153 |
||||
| Si, мг/л |
0.000 |
Жо - расчетное значение, мг-экв/л |
3.484 |
||||
| БО, мгО2/л |
5.350 |
CC, расчетное значение мг/л |
297.984 |
||||
| ПО, мгО2/л |
2.000 |
Электропроводность, СfмкСм/см |
362.783 |
||||
| Dk,мг-экв/л |
0.500 |
||||||
Вывод: Величина pH имеет оптимальное значение, т.к. входит в интервал 5,5-7,5. Бикарбонатная щелочность увеличилась на дозу коагулянта, а содержание сульфатов увеличилось.
Коагуляция исходной воды
В данном случае, в качестве коагулянта использовался сернокислый алюминий Al2(SO4)3.
Доза добавляемого коагулянта:
Dk = 0,07.ПО = 0,12.8,1 = 0,972мг-экв/л.
Т.к. Dk>0,5 принимаем это значение равное 0,5 мг-экв/л.
Оптимальное значение рН при коагуляции с сернокислым алюминием находится в интервале 5,5 – 7,5. Значение величины рН среды при коагуляции оказывает влияние на скорость и полноту гидролиза.
При коагуляции в обрабатываемой воде увеличивается содержание сульфатов, но уменьшается бикарбонатная щелочность на дозу коагулянта. Катионный состав воды не меняется.
Таблица 3
| Молекуляр- |
Эквивалент- |
Обозначения |
Концентрации(С СаСl2,Ca=HCO3) |
После гидратного известкования |
Электропровод- |
||||||||||||||||
| ная масса "М" |
ная масса "Э" |
[H] мг/кг |
[C] мг-экв/кг |
[N] моль/кг |
% |
[H] мг/кг |
[C] мг-экв/кг |
[N] моль/кг |
% |
ность,мкСм/см |
|||||||||||
| 40,08 |
20,04 |
Ca2+ |
65,606 |
3,274 |
0,0016 |
0,0066 |
31,088 |
1,551 |
0,0008 |
0,0031 |
69,44 |
||||||||||
| 24,03 |
12,01 |
Mg2+ |
10,8 |
0,899 |
0,0004 |
0,0011 |
7,782 |
0,648 |
0,0003 |
0,0008 |
30,74 |
||||||||||
| 23 |
23 |
Na+ |
11,884 |
0,517 |
0,0005 |
0,0012 |
11,884 |
0,517 |
0,0005 |
0,0012 |
24,11 |
||||||||||
| 1 |
1 |
H+ |
|||||||||||||||||||
| Сумма Kt |
4,69 |
2,716 |
|||||||||||||||||||
| 17 |
17 |
OH- |
5,100 |
0,300 |
0,0003 |
0,0005 |
55,4 |
||||||||||||||
| 61 |
61 |
HCO3- |
199,7 |
3,274 |
0,0033 |
0,02 |
19,215 |
0,315 |
0,0003 |
0,0019 |
13,05 |
||||||||||
| 60 |
30 |
CO32- |
5,550 |
0,185 |
0,0001 |
0,0006 |
9,65 |
||||||||||||||
| 96 |
48 |
SO42- |
17,3 |
0,360 |
0,0002 |
0,0017 |
41,3 |
0,860 |
0,0004 |
0,0041 |
51,8 |
||||||||||
| 35,46 |
35,46 |
Cl- |
37,43 |
21,056 |
0,0011 |
0,0037 |
37,43 |
1,056 |
0,0011 |
0,0037 |
75,06 |
||||||||||
| Сумма An |
4,69 |
2,716 |
|||||||||||||||||||
| Обозначения |
Значения |
Обозначения и расчетные формулы |
Значения |
||||||||||||||||||
| NH4+, мг/л |
0,3 |
моль/л |
0,004 |
||||||||||||||||||
| NO2-, мг/л |
0,011 |
f' |
0,931 |
||||||||||||||||||
| NO3-, мг/л |
0,055 |
f'' |
0,752 |
||||||||||||||||||
| Fe, мг/л |
0,33 |
СО2 моль/л |
0,0005 |
||||||||||||||||||
| P, мг/л |
0,022 |
pH |
10,446 |
||||||||||||||||||
| Si, мг/л |
0 |
Жо - расчетное значение, мг-экв/л |
2,199 |
||||||||||||||||||
| БО, мгО2/л |
5,35 |
CC, расчетное значение мг/л |
154,249 |
||||||||||||||||||
| ПО, мгО2/л |
2 |
Электропроводность, СfмкСм/см |
329,249 |
||||||||||||||||||
| Dk,мг-экв/л |
0,5 |
||||||||||||||||||||
| Dи,мг-экв/л |
3,78 |
||||||||||||||||||||
| Иизв,мг-экв/л |
0,300 |
||||||||||||||||||||
| DCaCl2,мг-экв/л |
-0,689 |
||||||||||||||||||||
| Mg2+max |
0,596 |
||||||||||||||||||||
Коагуляция с известкованием исходной воды (гидратный режим)
Гидратный режим известкования благоприятен для удаления магния, соединений железа, кремния и для осветления воды.
Для расчёта данной таблицы использовали коагулянт – сернокислое железо FeSO4 и гашёную известь Са(ОН)2. Оптимальное значение рН находится в интервале 9 – 10,5. Доза коагулянта Dk = 0,5 мг-экв/л.
Т.к. воды относятся к III группе и являются щелочными, т.е содержание ионов НСО3- находится в избытке по сравнению с остаточной жесткостью, то известкование в этом случае является нецелесообразным. Воду из III группы переводят в I путем добавления CaCl2 эквивалентно содержанию HCO3-.
Доза извести считается следующим образом:
Dи = СО2исх + ΔНСО3- + Dk+Ии, мг-экв/л;
Приняв значение ОН, определяем остаточную концентрацию иона Mg2+.
Mg2+ост = ![]() мг-экв/л.
мг-экв/л.
Используя закон электронейтральности, находим остаточную концентрацию ионов Са2+:
Концентрация сульфатов увеличивается на дозу коагулянта.
Таблица 4
| Молекуляр- |
Эквивалент- |
Обозначения |
Концентрации(С СаСl2,Ca=HCO3) |
После бикарбонатного известкования |
Электропровод- |
||||||||
| ная масса "М" |
ная масса "Э" |
[H] мг/кг |
[C] мг-экв/кг |
[N] моль/кг |
% |
[H] мг/кг |
[C] мг-экв/кг |
[N] моль/кг |
% |
ность, мкСм/см |
|||
| 40,08 |
20,04 |
Ca2+ |
51,8 |
2,585 |
0,0013 |
0,0052 |
21,443 |
1,07 |
0,0005 |
0,0021 |
48,48 |
||
| 24,03 |
12,01 |
Mg2+ |
10,8 |
0,899 |
0,0004 |
0,0011 |
10,8 |
0,899 |
0,0004 |
0,0011 |
43,17 |
||
| 23 |
23 |
Na+ |
11,884 |
0,517 |
0,0005 |
0,0012 |
11,884 |
0,517 |
0,0005 |
0,0012 |
24,18 |
||
| 1 |
1 |
H+ |
|||||||||||
| Сумма Kt |
4,001 |
2,486 |
|||||||||||
| 17 |
17 |
OH- |
1,190 |
0,070 |
0,0001 |
0,0001 |
12,97 |
||||||
| 61 |
61 |
HCO3 - |
199,7 |
3,274 |
0,0033 |
0,02 |
23,485 |
0,385 |
0,0004 |
0,0023 |
16,0 |
||
| 60 |
30 |
CO3 2- |
3,450 |
0,115 |
0,0001 |
0,0003 |
6,07 |
||||||
| 96 |
48 |
SO4 2- |
17,3 |
0,36 |
0,0002 |
0,0017 |
41,3 |
0,86 |
0,0004 |
0,0041 |
52,42 |
||
| 35,46 |
35,46 |
Cl- |
37,43 |
1,056 |
0,0011 |
0,0037 |
37,43 |
1,056 |
0,0011 |
0,0037 |
75,28 |
||
| Сумма An |
4,69 |
2,486 |
|||||||||||
| Обозначения |
Значения |
Обозначения и расчетные формулы |
Значения |
||||||||||
| NH4 + , мг/л |
0,3 |
моль/л |
0,004 |
||||||||||
| NO2 - , мг/л |
0,011 |
f' |
0,934 |
||||||||||
| NO3 - , мг/л |
0,055 |
f'' |
0,761 |
||||||||||
| Fe, мг/л |
0,03 |
СО2 моль/л |
0,0005 |
||||||||||
| P, мг/л |
0,022 |
pH |
9,816 |
||||||||||
| Si, мг/л |
0 |
Жо - расчетное значение, мг-экв/л |
1,969 |
||||||||||
| БО, мгО2 /л |
5,35 |
CC, расчетное значение мг/л |
149,792 |
||||||||||
| ПО, мгО2 /л |
2,0 |
Электропроводность, СfмкСм/см |
278,574 |
||||||||||
| Dk,мг-экв/л |
0,5 |
||||||||||||
| Dи,мг-экв/л |
3,481 |
||||||||||||
| Иизв,мг-экв/л |
0,07 |
||||||||||||
| DCaCl2,мг-экв/л |
0 |
||||||||||||
Коагуляция и известкование исходной воды (карбонатный режим)
В качестве коагулянта используется сернокислое железо, доза которого Dk = 0,5 мг-экв/л.
Доза извести считается следующим образом:
Dи = СО2исх + ΔНСО3- + Dk+Ии, мг-экв/л;
Приняв значение ОН, определяем остаточную концентрацию иона Mg2+.
Mg2+ост = ![]() мг-экв/л.
мг-экв/л.
Концентрацию магния не изменяется.
Остаточная концентрация кальция рассчитывается из закона электронейтральности (концентрация ионов магния и натрия не изменяется):
Карбонатный режим применяют: 1) когда вынужденно приходится использовать в качестве коагулянта сернокислый алюминий; 2) при необходимости исключить выделение магниевых соединений, чтобы в случае соблюдения определённых гидравлических условий получать при известковании крупнокристаллический осадок. При карбонатном режиме несколько уменьшается расход извести (по сравнению с гидратным режимом).
Таблица 5
| Молекуляр- |
Эквивалент- |
Обозначения |
Концентрации(С СаСl2,Ca=HCO3) |
После известкования и содирования |
Электропровод- |
|||||||||||||
| ная масса "М" |
ная масса "Э" |
[H] мг/кг |
[C] мг-экв/кг |
[N] моль/кг |
% |
[H] мг/кг |
[C] мг-экв/кг |
[N] моль/кг |
% |
ность,мкСм/см |
||||||||
| 40,08 |
20,04 |
Ca2+ |
65,606 |
3,274 |
0,0016 |
0,0066 |
1,922 |
0,096 |
0,00005 |
0,0002 |
4,54 |
|||||||
| 24,03 |
12,01 |
Mg2+ |
10,8 |
0,899 |
0,0004 |
0,0011 |
5,185 |
0,432 |
0,0002 |
0,0005 |
21,64 |
|||||||
| 23 |
23 |
Na+ |
11,884 |
0,517 |
0,0005 |
0,0012 |
11,884 |
2,238 |
0,0005 |
0,0012 |
105,89 |
|||||||
| 1 |
1 |
H+ |
||||||||||||||||
| Сумма Kt |
4,69 |
8,199 |
||||||||||||||||
| 17 |
17 |
OH- |
5,950 |
0,350 |
0,0004 |
0,0006 |
65,54 |
|||||||||||
| 61 |
61 |
HCO3- |
199,7 |
3,274 |
0,0033 |
0,02 |
12,200 |
0,200 |
0,0002 |
0,0012 |
8,4 |
|||||||
| 60 |
30 |
CO32- |
9,000 |
0,300 |
0,0002 |
0,0009 |
16,53 |
|||||||||||
| 96 |
48 |
SO42- |
17,3 |
0,36 |
0,0002 |
0,0017 |
41,3 |
0,86 |
0,0004 |
0,0041 |
54,74 |
|||||||
| 35,46 |
35,46 |
Cl- |
37,43 |
1,056 |
0,0011 |
0,0037 |
37,43 |
1,056 |
0,0011 |
0,0037 |
76,1 |
|||||||
| Сумма An |
4,69 |
2,766 |
||||||||||||||||
| Обозначения |
Значения |
Обозначения и расчетные формулы |
Значения |
|||||||||||||||
| NH4+, мг/л |
0,3 |
моль/л |
0,003 |
|||||||||||||||
| NO2-, мг/л |
0,011 |
f' |
0,944 |
|||||||||||||||
| NO3-, мг/л |
0,055 |
f'' |
0,795 |
|||||||||||||||
| Fe, мг/л |
0,030 |
СО2 моль/л |
0,0005 |
|||||||||||||||
| P, мг/л |
0,022 |
pH |
10,519 |
|||||||||||||||
| Si, мг/л |
0 |
Жо - расчетное значение, мг-экв/л |
0,528 |
|||||||||||||||
| БО, мгО2/л |
5,35 |
CC, расчетное значение мг/л |
158,519 |
|||||||||||||||
| ПО, мгО2/л |
42,0 |
Электропроводность, СfмкСм/см |
353,369 |
|||||||||||||||
| Dk,мг-экв/л |
0,5 |
|||||||||||||||||
| Dи,мг-экв/л |
3,948 |
|||||||||||||||||
| Иизв,мг-экв/л |
0,350 |
|||||||||||||||||
| Dс,мг-экв/л |
1,722 |
|||||||||||||||||
| DCaCl2,мг-экв/л |
-0,689 |
|||||||||||||||||
| Mg2+max |
0,403 |
|||||||||||||||||
| Са2+мах |
0,088 |
|||||||||||||||||
Коагуляция с известкованием и содированием исходной воды
Доза извести считается следующим образом:
Dи = СО2исх + ΔНСО3- + Dk+Ии, мг-экв/л;
Происходящие при известково-содовом умягчении основные химические процессы описываются следующими уравнениями:
а2СО3 → 2 Nа+ + СО32-;
Са(ОН)2 → Са2+ +2ОН-;
СО2 + 2ОН- → СО32- + Н2О;
Н+ + ОН- → Н2О
НСО3- → Н+ + СО32-
НСО3- + ОН- = СО32- + Н2О;
Са2+ + СО32- → СаСО3↓;
Мg2+ + 2ОН- → Мg(ОН)2↓.
Приняв значение ОН- определяем остаточную концентрацию ионов кальция и магния. Концентрация сульфатов увеличивается на дозу коагулянта.
Т.о. остаточную концентрацию натрия определяем из закона электронейтральности.
Таблица 6
| Молекуляр- |
Эквивалент- |
Обозначения |
Концентрации(С СаСl2,Ca=HCO3) |
После известкования с обескремниванием |
Электропровод- |
|||||||||||||
| ная масса "М" |
ная масса "Э" |
[H] мг/кг |
[C] мг-экв/кг |
[N] моль/кг |
% |
[H] мг/кг |
[C] мг-экв/кг |
[N] моль/кг |
% |
ность, мкСм/см |
||||||||
| 40,08 |
20,04 |
Ca2+ |
65,606 |
3,274 |
0,0016 |
0,0066 |
33,328 |
1,663 |
0,00108 |
0,0033 |
74,53 |
|||||||
| 24,03 |
12,01 |
Mg2+ |
108 |
0,899 |
0,0004 |
0,0011 |
6,440 |
0,536 |
0,0003 |
0,0006 |
25,46 |
|||||||
| 23 |
23 |
Na+ |
11,884 |
0,517 |
0,0005 |
0,0012 |
11,884 |
0,517 |
0,0005 |
0,0012 |
24,12 |
|||||||
| 1 |
1 |
H+ |
||||||||||||||||
| Сумма Kt |
4,69 |
0,276 |
||||||||||||||||
| 17 |
17 |
OH- |
5,100 |
0,300 |
0,0003 |
0,0005 |
55,42 |
|||||||||||
| 61 |
61 |
HCO3- |
1997 |
3,274 |
0,0033 |
0,02 |
23,485 |
0,385 |
0,0004 |
0,0023 |
15,96 |
|||||||
| 60 |
30 |
CO32- |
3,450 |
0,115 |
0,0001 |
0,0003 |
6,00 |
|||||||||||
| 96 |
48 |
SO42- |
17,3 |
0,36 |
0,00202 |
0,0017 |
41,3 |
0,86 |
0,0004 |
0,0041 |
51,85 |
|||||||
| 35,46 |
35,46 |
Cl- |
37,43 |
1,056 |
0,0011 |
0,0037 |
37,43 |
1,056 |
0,0011 |
0,0037 |
75,08 |
|||||||
| Сумма An |
4,69 |
2,716 |
||||||||||||||||
| Обозначения |
Значения |
Обозначения и расчетные формулы |
Значения |
|||||||||||||||
| NH4+, мг/л |
0,3 |
моль/л |
0,004 |
|||||||||||||||
| NO2-, мг/л |
0,011 |
f' |
0,932 |
|||||||||||||||
| NO3-, мг/л |
0,055 |
f'' |
0,753 |
|||||||||||||||
| Fe, мг/л |
0,03 |
СО2 моль/л |
0,00052 |
|||||||||||||||
| P, мг/л |
0,022 |
pH |
10,446 |
|||||||||||||||
| Si, мг/л |
0 |
Жо - расчетное значение, мг-экв/л |
2,199 |
|||||||||||||||
| БО, мгО2/л |
5,35 |
CC, расчетное значение мг/л |
157,317 |
|||||||||||||||
| ПО, мгО2/л |
2,0 |
Электропроводность, СfмкСм/см |
328,418 |
|||||||||||||||
| Dk,мг-экв/л |
0,5 |
|||||||||||||||||
| Dи,мг-экв/л |
3,711 |
|||||||||||||||||
| Иизв,мг-экв/л |
0,300 |
|||||||||||||||||
| DCaCl2,мг-экв/л |
0,689 |
|||||||||||||||||
| Mg2+max |
0,493 |
|||||||||||||||||
Вывод: Для данных вод с содержанием ГДП>2 мг/л, Ок>4 мгО2/л, Жк>2 мг-экв/л, Жнк<10 мг-экв/л, концентрацией Si<3 мг/л оптимальной схемой предочистки является К+Иг+Ф и К+Иб+Ф.
Коагуляция с известкованием и магнезиальным обескремниванием исходной воды
Основным из числа методов магнезиального обескремнивания воды является метод обескремнивания каустическим магнезитом. Одновременно с обескремниванием воды проводят её известкование и коагуляцию.
Известкование при магнезиальном обескремнивании производится для того, чтобы снизить щёлочность воды и создать должную величину рН. При рН<10удаление кремнекислых соединений будет затруднено из-за недостаточной диссоциации Н2SiО3. Кроме того, вследствие низкой концентрации в воде ионов ОН- обескремнивающий реагент будет взаимодействовать с бикарбонат-ионами исходной воды, свободной угольной кислотой, а также введённым в воду коагулянтом:
МgО + Н2О → Мg(ОН)2 → Мg2+ + 2ОН-;
ОН- + Н+ → Н2О;
НСО3- → СО32- + Н+;
СО2 + Н2О → Н2СО3 → Н+ + НСО3- → 2 Н+ + СО32-;
СО32- + Са2+ → СаСО3↓;
2 ОН- + Fе2+ → Fе(ОН)2.
Экспериментальные данные подтверждают, что обескремнивание наиболее эффективно происходит в узком интервале величин рН=10,1 – 10,3, достигая в отдельных случаях 10,4. Оптимум рН несколько различен для разных вод.
Доза извести считается следующим образом:
Dи = СО2исх + ΔНСО3- + Dk+Ии, мг-экв/л;
При расчёте данной таблицы использовали коагулянт FeSO4, доза которого Dk = 0,5 мг-экв/л, остаточную концентрацию кальция определяем из закона электронейтральности.
Таблица 7
| Обозначение |
Ед. изм. |
Числ. Знач. |
| N |
МВт |
210 |
| Qдв=(Q01+Q02+Q03+Q04+Q05) |
т/ч |
215.6 |
| Q01=nrD1 |
т/ч |
126.63 |
| Q02 |
т/ч |
25 |
| Q03=0,12*0,15*0,7*n*N |
т/ч |
42.34 |
| Q04=nr1D1z |
т/ч |
2.01 |
| Q05=0,1*(Q01+Q02+Q03+Q04) |
т/ч |
19.6 |
| D1 |
т/ч |
670 |
| n |
шт |
6 |
| r |
доли |
0.03 |
| X1 |
доли |
0.05 |
| X |
доли |
0.02 |
| r1 |
доли |
0.03 |
| z |
доли |
0.1 |
| Qдвб=(1+X) (1+X1)*Qдв |
т/ч |
446,29 |
Вывод: Количество воды, поступающей в осветлители на обработку известью и другими реагентами составляет Qдвб=446,9 т/ч.
Расчет производительности ВПУ
Производительность ВПУ по обессоленной воде:
![]() ,
,
где ![]() - потеря суммарной паропроизводительности парогенераторов, т/ч:
- потеря суммарной паропроизводительности парогенераторов, т/ч:
![]() ,
,
r – доля потери пара и конденсата в контуре блока;
n=6 - количество энергоблоков на станции;
![]() - паропроизводительность парогенератора, т/ч;
- паропроизводительность парогенератора, т/ч;
![]() - дополнительная производительность установки, зависящая от мощности блока, т/ч;
- дополнительная производительность установки, зависящая от мощности блока, т/ч;
![]() - дополнительная производительность ВПУ, связанная с возможной потерей конденсата при разогреве мазута, т/ч. Для АЭС
- дополнительная производительность ВПУ, связанная с возможной потерей конденсата при разогреве мазута, т/ч. Для АЭС ![]() =0;
=0;
![]() - потери пара конденсата, которые возникают в теплосетях, т/ч:
- потери пара конденсата, которые возникают в теплосетях, т/ч:
![]() ,
,
z – доля потери конденсата в подогревателях воды тепловых сетей;
r1 – доля отбора пара на подогрев воды в тепловых сетях;
![]() - дополнительная производительность для компенсации отпуска воды на другие объекты, т/ч:
- дополнительная производительность для компенсации отпуска воды на другие объекты, т/ч:
![]()
Количество исходной воды, поступающей в осветлитель, т/ч:
![]()
х - доля потери воды с продувкой воды (при обезвоживании шлама и возврате фугата в осветлитель х=0);
х1 - доля потери на собственные нужды.
Таблица 8
| Расчет оборотной системы охлаждения |
||||||||
| Обознач. |
Ед. изм. |
Исх. вода |
ОСО 1 |
+H2SO4 |
ОСО 2 |
+H2SO4 |
OCO 3 |
|
| Ca2+ |
мг-экв/л |
5,87 |
Нецелесообразно, т.к концентрация HCO3- в исходной воде превышает нормированное значение 3 мг-экв/л |
5,87 |
39,09 |
5,87 |
41,36 |
|
| Mg2+ |
мг-экв/л |
2,96 |
2,96 |
19,75 |
2,96 |
20,89 |
||
| Na+ |
мг-экв/л |
3,82 |
3,82 |
25,43 |
3,82 |
26,91 |
||
| ∑Кt |
мг-экв/л |
12,65 |
12,65 |
84,27 |
12,65 |
89,16 |
||
| OH- |
мг-экв/л |
0 |
0 |
0 |
0 |
0 |
||
| HCO3- |
мг-экв/л |
5,09 |
0,45 |
3,00 |
0,45 |
6,00 |
||
| Cl- |
мг-экв/л |
3,56 |
3,56 |
23,69 |
3,56 |
25,07 |
||
| SO42- |
мг-экв/л |
4,00 |
8,64 |
57,58 |
8,64 |
58,10 |
||
| ∑An |
мг-экв/л |
12,65 |
12,65 |
84,27 |
12,65 |
89,16 |
||
| µ |
моль/л |
0,01907 |
0,14249 |
0,14934 |
||||
| f' |
0,8696305 |
0,72942858 |
0,72549367 |
|||||
| f" |
0,571925 |
0,28309428 |
0,27703492 |
|||||
| СО2р |
моль/л |
0,00061 |
0,00049 |
0,00201 |
||||
| pHр |
7,3260001 |
7,11390278 |
6,80012363 |
|||||
| Dк |
4,64149119 |
4,24 |
||||||
| p1 |
1,2 |
1,2 |
||||||
| p2 |
0,05 |
0,05 |
||||||
| p3 |
0,1619375 |
0,1483932 |
||||||
| ∆t |
°С |
10 |
||||||
| К |
0,12 |
|||||||
| Ку |
6,6620463 |
7,0485945 |
||||||
| Dпг |
т/ч |
6160 |
6160 |
|||||
| n |
шт |
3 |
6 |
|||||
| r |
кДж/кг |
2424,34 |
2424,34 |
|||||
| Dn |
т/ч |
18480 |
18480 |
|||||
| Dk |
т/ч |
11088 |
11088 |
|||||
| D3 |
т/ч |
1731,5256 |
1586,70235 |
|||||
| D3 |
т/год |
12120679,6 |
11106916,4 |
|||||
| D2 |
т/ч |
534,627723 |
534,627723 |
|||||
| D2 |
т/год |
3742394,06 |
3742394,06 |
|||||
| D1 |
т/ч |
12831,0654 |
12831,0654 |
|||||
| D1 |
т/год |
89817457,5 |
89817457,5 |
|||||
| Do |
т/ч |
1069255,45 |
1069255,45 |
|||||
| Добавочная вода |
15097,2187 |
14952,3954 |
||||||
| Ca2+*f''*SO42-*f" |
4,51E-05 |
4,61E-05 |
||||||
| ПРCaSO4 |
2,50E-05 |
2,50E-05 |
||||||
| -80,41826 |
-84,43813 |
|||||||
| Обознач. |
Ед. изм. |
Исх. вода |
Изв г.р. |
+H2SO4 |
ОСО 4 |
Изв б.р. |
+H2SO4 |
ОСО 4 |
Изв с. |
+H2SO4 |
| Ca2+ |
мг-экв/л |
5,87 |
3,62 |
3,62 |
60,78 |
1,07 |
1,07 |
26,75 |
0,10 |
0,10 |
| Mg2+ |
мг-экв/л |
2,96 |
0,65 |
0,65 |
10,89 |
2,96 |
2,96 |
74,10 |
0,43 |
0,43 |
| Na+ |
мг-экв/л |
3,82 |
3,82 |
3,82 |
64,16 |
3,82 |
3,82 |
95,44 |
7,60 |
7,60 |
| ∑Кt |
мг-экв/л |
12,65 |
8,08 |
8,08 |
135,829 |
7,85 |
7,85 |
196,29 |
8,13 |
8,13 |
| OH- |
мг-экв/л |
0 |
0,30 |
0,00 |
0,00 |
0,07 |
0,00 |
0,00 |
0,35 |
0,00 |
| HCO3- |
мг-экв/л |
5,09 |
0,50 |
0,36 |
6,00 |
0,50 |
0,24 |
6,00 |
0,50 |
0,24 |
| Cl- |
мг-экв/л |
3,56 |
2,78 |
2,78 |
46,72 |
2,78 |
2,78 |
69,49 |
2,78 |
2,78 |
| SO42- |
мг-экв/л |
4,00 |
4,50 |
4,95 |
82,11 |
4,50 |
4,83 |
120,80 |
4,50 |
5,11 |
| ∑An |
мг-экв/л |
12,65 |
8,08 |
8,08 |
135,83 |
7,85 |
7,85 |
196,29 |
8,13 |
8,13 |
| µ |
моль/л |
0,01907 |
0,21322 |
0,307 |
||||||
| f' |
0,8696305 |
0,6951114 |
0,663 |
|||||||
| f" |
0,571925 |
0,2334628 |
0,1935 |
|||||||
| СО2р |
моль/л |
0,00061 |
0,00229 |
0,00076 |
||||||
| pHр |
7,326 |
6,726 |
7,187021 |
|||||||
| Dк |
0,44 |
0,33 |
0,61 |
|||||||
| p1 |
1,2 |
1,2 |
||||||||
| p2 |
0,05 |
0,05 |
||||||||
| p3 |
0,026 |
0 |
||||||||
| ∆t |
°С |
10 |
||||||||
| К |
0,12 |
|||||||||
| Ку |
16,807 |
25 |
||||||||
| Dпг |
т/ч |
6160 |
6160 |
|||||||
| n |
шт |
3 |
3 |
|||||||
| r |
кДж/кг |
2424,34 |
2424,34 |
|||||||
| Dn |
т/ч |
18480 |
18480 |
|||||||
| Dk |
т/ч |
11088 |
11088 |
|||||||
| D3 |
т/ч |
277,1124 |
0 |
|||||||
| D3 |
т/год |
1939786,7 |
0 |
|||||||
| D2 |
т/ч |
534,62772 |
534,628 |
|||||||
| D2 |
т/год |
3742394,1 |
3742394,1 |
|||||||
| D1 |
т/ч |
12831,065 |
12831,065 |
|||||||
| D1 |
т/год |
89817457,5 |
89817457 |
|||||||
| Do |
т/ч |
1069255,4 |
1069255,4 |
|||||||
| Добавочная вода |
13642,805 |
13365,693 |
||||||||
| Ca2+*f''*SO42-*f" |
6,88E-05 |
3,03E-05 |
||||||||
| ПРCaSO4 |
2,50E-05 |
2,50E-05 |
||||||||
| 16,81 |
25 |
Вывод: оптимальным является режим с минимальной величиной продувки, в данном случае - бикарбонатный режим известкования и известкование с содированием.
Оборотные системы охлаждения (ОСО)
Расчет потерь воды в ОСО
В результате циркуляции по замкнутому циклу в системе охлаждения часть оборотной воды выводится из системы вследствие испарения ![]() , часть выносится из градирни в виде капельного уноса
, часть выносится из градирни в виде капельного уноса ![]() и, наконец, еще одна ее часть выводится из системы в виде продувки или на технологические нужды
и, наконец, еще одна ее часть выводится из системы в виде продувки или на технологические нужды ![]() .
.
Коэффициент концентрирования не выпадающих в осадок солей:
![]() ,
,
![]()
где к – зависит от температуры воздуха,
∆t - охлаждение воды в градирне, принимается 5-10![]() .
.
![]() выбирается в зависимости от вида градирни. Выбираем башенную градирню c каплеуловителем. Для неё:
выбирается в зависимости от вида градирни. Выбираем башенную градирню c каплеуловителем. Для неё:
![]() =0,05.
=0,05.
![]() задаемся в каждом случае отдельно.
задаемся в каждом случае отдельно.
ОСО1
Т.к. концентрация НСО3- в исходной воде больше 3 мг-экв/л, расчет не производится, т.к. система является нецелесообразной
ОСО2
Для предупреждения выпадения гипса необходимо выдерживать такое неравенство:
Ca2+ < 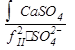 .
.
Где, CaSO4 = 2,5 10-5 (моль/кг)2.
Доза серной кислоты:
![]()
Рассчитываем ![]() для данной системы охлаждения:
для данной системы охлаждения:
![]()
![]()
![]() .
.
![]()
ОСО3
Добавляем оксиэдилдифосфоновую (ОЭДФК) и серную кислоты. Проверяем выпадет ли в осадок ![]() :
:
![]() <2,5·10-5
<2,5·10-5
(табличное значение),значит не выпадет.
Рассчитываем ![]() для данной системы охлаждения:
для данной системы охлаждения:
Доза серной кислоты:
![]()
ОСО4
Добавляем оксиэдилдифосфоновую (ОЭДФК) и серную кислоты. Проверяем выпадет ли в осадок ![]() :
:
![]() <2,5·10-5
<2,5·10-5
(табличное значение),значит не выпадет.
Добавляем известь и серную кислоту, проверяем, выпадет ли в осадок ![]() .
.
![]() <2,5·10-5
<2,5·10-5
(табличное значение),значит не выпадет.
Рассчитываем ![]() для данной системы охлаждения:
для данной системы охлаждения:
![]()
Таблица 9
| Поверочный расчёт производительности осветлителя |
||
| 4 осветлителя 250-И |
||
| Обознач. |
Ед. изм. |
Числ. Знач. |
| Qр |
т/ч |
253.46 |
| Fкс |
м2 |
53,00 |
| Vo |
мм/с |
1,33 |
| Co |
мг/л |
0,109 |
| П |
м |
3 |
| aс |
0,907 |
|
| Hc |
м |
2,3 |
| aк |
% |
6,17 |
| Dк |
мг-экв/л |
0,567 |
| Э |
36 |
|
| ГДПбв |
мг/л |
330,94 |
| ГДП |
мг/л |
11 |
| ГДПнк |
мг/л |
-140,15 |
| ГДПк |
мг/л |
460 |
| Vy |
мм/с |
2,15 |
| t |
°C |
20 |
Вывод: т.к.,(|898.2- 250*4|/898.2)*100= 11.34 % выбранные осветлители 250-И подходят по производительности.
Поверочный расчет осветлителя
Выбор осветлителя: необходимо выбирать не менее двух одинаковых осветлителей (т.к. обязательно нужен резервный на случай выхода из строя одного из осветлителей) и не более трех, т.к. на их обслуживание идут большие экономические затраты.
Выбираем 4 осветлителя 250-И.
Производительность осветлителя, ![]() :
:
![]() .
.
где ![]() - площадь поперечного сечения зоны контактной среды,
- площадь поперечного сечения зоны контактной среды, ![]() :
:
![]() =11
=11![]() ,
,
![]() - расчетная скорость восходящего движения воды на выходе из контактной зоны осветлителя,
- расчетная скорость восходящего движения воды на выходе из контактной зоны осветлителя, ![]() :
:
![]() :
:
где ![]() - условная скорость свободного осаждения шлама, мм/с (находим по
- условная скорость свободного осаждения шлама, мм/с (находим по ![]() ):
):
![]()
где ![]() - доза коагулянта, мг-экв/л,
- доза коагулянта, мг-экв/л,
Э – эквивалент коагулянта,
t – температура воды в интервале ![]() С;
С;
![]() - объемная концентрация шлама в зоне контактной среды осветлителя, мл/мл:
- объемная концентрация шлама в зоне контактной среды осветлителя, мл/мл:
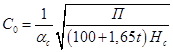 ,
,
где П – прозрачность воды по кресту, см:
П=300![]() ,
,
![]() =1 (по диаметру осветлителя),
=1 (по диаметру осветлителя),
Приведенная высота зоны контактной среды осветлителя, м:
![]() =1,8 м,
=1,8 м,
![]() - суммарное количество грубодисперсных примесей, поступающих в осветлитель и образующихся в нем, мг/л.
- суммарное количество грубодисперсных примесей, поступающих в осветлитель и образующихся в нем, мг/л.
Выбранный осветлитель 250-И подходит нам по производительности.
Выводы: Для данной исходной воды с содержанием ГДП>2 мг/л, Ок>4 мгО2/л, Жк>2 мг-экв/л, Жнк<10 мг-экв/л, концентрацией Si<3 мг/л оптимальным является гидратный режим известкования (стр 31[1]), при котором величина продувки имеет минимальное значение и затраты на реагенты меньшие.
Список использованной литературы
1. Кишневский В.А. Современные методы обработки воды в энергетике: Учебное пособие. - Одесса: ОГПУ,1999-196 с.
2. Громогласов А.А., Копылов А.С., Пильщиков А.П. Водоподготовка: Процессы и аппараты: Учеб. пособие для вузов.-М.: Энергоатомиздат,1990-272с.
3. Кульский Л.А., Строкач П.П. Технология очистки природных вод.-Киев: Вища школа. Головное изд-во,1981.-328 с.
4. Стерман Л.С. и др.Тепловые и атомные электростанции: Учебник для вузов.- М.: Энергоиздат,1982.-456 с., ил.
Похожие работы
-
Развитие представлений о природе тепловых явлений и свойств макросистем
Развитие представлений о природе тепловых явлений и свойств макросистем Вокруг нас происходят явления, внешне весьма косвенно связанные с механическим движением. Это явления, наблюдаемые при изменении температуры тел, представляющих собой макросистемы, или при переходе их из одного состояния (например, жидкого) в другое (твердое либо газообразное).
-
Расчет рекуперативного теплообменника
Министерство образования и науки Украины ХНАГХ Кафедра: «Эксплуатации газовых и тепловых систем» КУРСОВАЯ РАБОТА ТЕМА: «Расчет рекуперативного теплообменника»
-
Дипольный момент молекулы и связи
Министерство общего и профессионального образования РФ Московский Государственный Технический Университет им. Н.Э.Баумана Доклад Дипольный момент молекулы и связи
-
Испытание теплообменников
Изучение процесса теплообмена в змеевике, кожухотрубчатом теплообменниках, экспериментальное определение коэффициента теплопередачи, рассчет коэффициента теплопередачи по предложенным зависимостям и сравнение опытных данных и рассчитанных значений.
-
Расчёт цикла паротурбинной установки
Проведение расчета по обратимому циклу Ренкина параметров воды и пара (сухого, перегретого) в характерных точках цикла, их удельных расходов на выработку электроэнергии, количества подведенного, отведенного тепла, термического КПД паротурбинной установки.
-
Тепло Термины и определения
Тепловая сеть система трубопроводов и потребительских вводов для транспорта и распределения теплоносителя (горячей воды или пара). Трубы прокладываются под землей в каналах или в грунте, а также над землей на эстакадах или на мачтах.
-
Теплотехника
ТЕСТОВЫЕ ВОПРОСЫ К ЭКЗАМЕНУ ПО КУРСУ «ТЕПЛОТЕХНИКА» 1.Понятие термодинамической системы. a) Это совокупность макроскопических тел; b) Это совокупность макроскопических тел, обменивающихся энергией.
-
Кожухотрубный теплообменник для нагревания смеси ацетон - вода до температуры кипения
Температурный расчет и определение теплофизических параметров теплоносителей при средних температурах. Расчет теплопередающей поверхности и изоляции. Определение гидравлических показателей. Расчет толщины обечайки, штуцеров, трубной решетки и опор.
-
Расчет роторно-поршневого двигателя
Определение параметров невозмущённого потока по заданным исходным данным. Расчет параметров во входном сечении и по тракту диффузора. Уравнение равенства секундного расхода. Расчет геометрических параметров в сопловой части заданного двигателя.
-
Расчет цикла паротурбинной установки
Для паротурбинной установки, работающей по обратимому циклу Ренкина можно определить работу, произведенную паром в турбине и затраченную на привод питательного насоса. Расчет теоретического расхода пара и тепла на выработку электроэнергии в цикле.