Название: Математическое моделирование нестационарного электрического поля анодной защиты
Вид работы: статья
Рубрика: Математика
Размер файла: 58.28 Kb
Скачать файл: referat.me-217319.docx
Краткое описание работы: Электрохимическая анодная защита основана на свойстве некоторых металлов, таких как железо, титан, хром, находящихся в контакте с кислотными или щелочными растворами, переходить в пассивное состояние при сдвиге потенциала в положительном направлении.
Математическое моделирование нестационарного электрического поля анодной защиты
Болотнов А.М.
http://www.bashedu.ru/str_n_col/vestnic/2/authors.htmlРассматривается математическая модель нестационарного электрического поля анодной защиты. Для описания анодных поляризационных кривых предлагается эмпирическая формула зависимости плотности тока от поляризации и скорости изменения потенциала. Входящие в формулу числовые параметры определяются по экспериментальным данным. В трех- и двумерных областях задача сводится к граничному интегральному уравнению для потенциала электрического поля, которое решается с помощью итерационной процедуры. Приводятся результаты численных расчетов пускового режима анодной защиты стального цилиндра, заполненного серной кислотой.
Введение
Электрохимическая анодная защита основана на свойстве некоторых металлов, таких как железо, титан, хром, находящихся в контакте с кислотными или щелочными растворами, переходить в пассивное состояние при сдвиге потенциала в положительном направлении. При этом зависимость “плотность тока – поляризация” имеет ярко выраженный немонотонный характер [1, 2]. В математических моделях анодную поляризационную кривую обычно аппроксимируют прямолинейными отрезками; катодную поляризацию либо не учитывают, либо заменяют линейной зависимостью [3–5].
Анодная защита широко применяется в технологическом оборудовании, контактирующем с кислотными растворами (емкости для хранения и транспортировки, теплообменные аппараты и др.). Стационарные режимы защиты характеризуются неизменным составом агрессивной среды, постоянными тепловыми и гидродинамическими параметрами, а также равномерным распределением защитного потенциала на поверхностях электрохимической системы [4, 6]. Пуск анодной защиты, связанный с начальной пассивацией защищаемых поверхностей, сопровождается высокими плотностями тока и значительной неравномерностью распределения защитного потенциала. Моделирование нестационарных электрических полей, связанных с пусковыми режимами анодной защиты, осложняется также зависимостью параметров анодной поляризационной кривой от скорости изменения потенциала [2, 6].
В предлагаемой модели реализованы граничные условия на электродах, построенные на основе экспериментальных данных. Катодная поляризационная кривая описывается экспоненциальной зависимостью плотности тока от поляризации, аналогичной формуле Тафеля. Для описания анодной поляризационной зависимости предложена немонотонная гладкая функция плотности тока от двух переменных: поляризации и скорости изменения потенциала. Данный подход дает возможность моделирования нестационарных электрических полей в электрохимических системах.
Математическая модель
Рассматривается заполненная проводящей средой область D, граница которой S состоит из анодных Sa, катодных Sk и изолированных Si участков: S=Sa Sc Si, ![]() =D S,
=D S,
Зависимость приложенного напряжения от времени U(t) предполагается линейной, в этом случае скорость пуска V=dU/dt постоянна и играет роль числового параметра. Потенциал электрического поля ![]() (p)определяется решением уравнения Лапласа [7]:
(p)определяется решением уравнения Лапласа [7]:
| p |
(1) |
где p![]() (x, y, z) в трехмерном случае и p
(x, y, z) в трехмерном случае и p![]() (x, y) – в двумерном.
(x, y) – в двумерном.
В электролите выполняется закон Ома, который на границе области записывается в виде:
| p |
e=a, k, i, | (2) |
где j - нормальная составляющая плотности тока; - электропроводность среды; n - внутренняя нормаль к границе S; индекс e равен a для анодов, k - катодов и i - изоляторов.
Соотношения для поляризации электродов представляются в виде [8]:
| p |
(3) | |
| p |
(4) |
где U=U(t) - межэлектродное напряжение.
Катодная поляризационная кривая описывается функцией:
| Jk( |
(5) |
где k1, k2 - константы, определяемые по экспериментальным данным.
Для описания анодных поляризационных кривых предложена функция:
| х | (6) |
где a1, ..., a4 - константы, определяемые по экспериментальным данным; V - скорость развертки напряжения.
Таким образом, для уравнения (1) сформулированы граничные условия: на катодах - (3), (5); на анодах - (4), (6); на изоляторах -
| j(p)=0, | p |
(7) |
Характеризующий коррозионные потери суммарный электрический заряд Q, проходящий через защищаемые поверхности Sa за время tp, определяется интегралом:
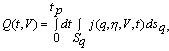 |
q |
(8) |
Если ставить задачу минимизации коррозионных потерь при пуске анодной защиты, то оптимальными в этом смысле следует считать такое количество и расположение катодов, при которых для выбранной скорости V электрический заряд Q, определяемый интегралом (8), минимален.
Вопросы численной реализации
Задача (1)-(7) решалась в трех- и двумерных областях для емкостей различной геометрии. Распределение потенциала определялось решением нелинейного интегрального уравнения, построенного на основе формулы Грина [9], которую с учетом (1) можно записать в виде:
| (9) |
где p, q![]() S;
S; ![]() =(m–1)
=(m–1)![]() , m - размерность задачи; G(p, q)=1/R(p, q) при m=3, G(p, q)= –ln[R(p, q)] при m=2; R(p, q) - расстояние между точками p и q. Из формулы (9) с учетом (2) получено интегральное уравнение:
, m - размерность задачи; G(p, q)=1/R(p, q) при m=3, G(p, q)= –ln[R(p, q)] при m=2; R(p, q) - расстояние между точками p и q. Из формулы (9) с учетом (2) получено интегральное уравнение:
для решения которого применяется итерационная процедура:
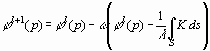 , , |
(11) |
где l - номер итерации; ядро K![]() K [p, q,
K [p, q, ![]() (q)] определяется соотношениями:
(q)] определяется соотношениями:
| K= |
q |
При выбранной скорости V счет проводился по времени t от 0 до tmax, при этом напряжение увеличивалось от 0 до Umax=V tmax. Затем знак V менялся на противоположный, t уменьшалось от tmax до 2 tmax, напряжение - от Umax до 0. По результатам расчета определялись границы пассивной зоны (U1, U2) и напряжение U, соответствующее минимальной плотности тока. Далее по формуле (8) определялся общий заряд пуска.
Итерационный процесс (11) оценивался по условию ![]() для всех p
для всех p![]() S. При выполнении очередного цикла итераций (11) для каждого t контролировалось выполнение балансового соотношения по току с относительной погрешностью 1 %.
S. При выполнении очередного цикла итераций (11) для каждого t контролировалось выполнение балансового соотношения по току с относительной погрешностью 1 %.
Для определения параметров в формулах (5), (6) были использованы данные, приведенные в [6] для стали 18 % Cr – 8 % Ni в 1N H2SO4 при 250 C. При этом получены значения параметров: k1=0.04315, k2=17.25, a1=350, a2=0.3, a3=17, a4=0.3.
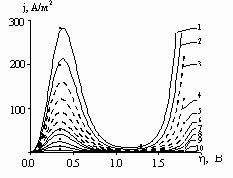
Рис. 1. Анодные поляризационные зависимости, построенные по формуле (6) для скоростей V, В/час: 1 – 720; 2 – 360; 3 – 180; 4 – 90; 5 – 45; 6 – 22,5; 7 – 12; 8 – 6; 9 – 1,6; 10 – 0,4; 11 – 0,025. Точками обозначены экспериментальные данные для скоростей V, В/час: 720; 360; 12; 6; 1,6; 0,4; 0,025.
На рис. 1 представлены анодные поляризационные зависимости j(![]() ), построенные по формуле (6). Сплошной линией выделены кривые, для которых экспериментальные данные [6] при тех же значениях скорости V нанесены точками. Точки выбраны из трех участков: 1) участка максимальной плотности тока в области активного растворения; 2) переходного участка; 3) участка пассивного состояния анода. Из рисунка видно, что предложенная зависимость (6) качественно согласуется с экспериментальными данными в исследуемом диапазоне значений скорости развертки потенциала.
), построенные по формуле (6). Сплошной линией выделены кривые, для которых экспериментальные данные [6] при тех же значениях скорости V нанесены точками. Точки выбраны из трех участков: 1) участка максимальной плотности тока в области активного растворения; 2) переходного участка; 3) участка пассивного состояния анода. Из рисунка видно, что предложенная зависимость (6) качественно согласуется с экспериментальными данными в исследуемом диапазоне значений скорости развертки потенциала.
Результаты расчетов
Приведем некоторые результаты численных расчетов пусковых режимов анодной защиты стального цилиндра, заполненного серной кислотой и защищаемого одним цилиндрическим катодом (рис. 2).
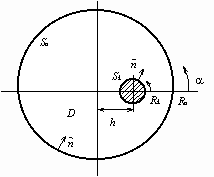
Рис. 2. Схема электрохимической системы. Sa – защищаемая поверхность; Sk – поверхность катода; Ra, Rk – радиусы анода и катода; h – расстояние между центрами электродов;![]() ,
,![]() – углы отсчета граничных точек на аноде и катоде; – нормаль к границе.
– углы отсчета граничных точек на аноде и катоде; – нормаль к границе.
Радиусы границ имеют значения: Ra=10 см, Rk=2 см; электропроводность среды ![]() =10 см/м. Расстояние между центрами границ h изменялось от 0 до 7 см. Напряжение U изменялось от 0 до Umax=2.4 В, затем обратно от Umax до 0.
=10 см/м. Расстояние между центрами границ h изменялось от 0 до 7 см. Напряжение U изменялось от 0 до Umax=2.4 В, затем обратно от Umax до 0.
На рис. 3 представлены зависимости потенциала в различных точках анода (а) и катода (б) от приложенного напряжения при скорости пуска V=36 В/час. Стрелками указаны решения при прямой и обратной развертке напряжения. На участке U1<U2<U3 наблюдаются два решения: верхнее соответствует активному растворению, нижнее - пассивному состоянию анода. Из рисунка видно, что для достижения пассивного состояния анода (U=U) необходимо вначале увеличивать напряжение U от 0 до U2 (верхняя ветвь графика), а затем уменьшать от U2 до U (нижняя ветвь). Волна пассивации перемещается по поверхности анода от точки ![]() =0 к удаленной точке
=0 к удаленной точке ![]() =, при этом защитный потенциал
=, при этом защитный потенциал ![]() возрастает (от линии 1 к линии 4).
возрастает (от линии 1 к линии 4).
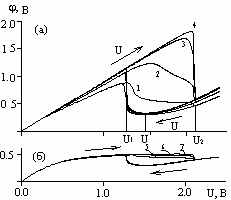
Рис. 3. Зависимость потенциала от приложенного напряжения при h=5 см; V=36 В/час на аноде (а) при углах![]() , равных, рад: 1 – 0; 2 –
, равных, рад: 1 – 0; 2 –![]() /3; 3 – 2
/3; 3 – 2![]() /3; 4 –
/3; 4 –![]() ; и на катоде (б) при углах
; и на катоде (б) при углах![]() , равных, рад: 5 – 0; 6 –
, равных, рад: 5 – 0; 6 –![]() /2; 7 – .
/2; 7 – .
В табл. 1 приведены параметры пассивной зоны (U1, U2) при различных расстояниях h между центрами границ. Из таблицы видно, что с увеличением h меняется ширина пассивной зоны, причем наименьшее значение (0.6) соответствует h=3.
Таблица 1. Интервал пассивной зоны при различных расстояниях h между центрами электродов
| h, см. | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| U2-U1, В | 0.97 | 0.80 | 0.64 | 0.60 | 0.72 | 0.84 | 0.89 | 1.01 |
На рис. 4 представлены зависимости плотности тока от напряжения в точках электродов, наименее удаленных друг от друга: (а) – в анодной точке ![]() =0, (б) – в катодной точке
=0, (б) – в катодной точке ![]() =0 при различных h.
=0 при различных h.
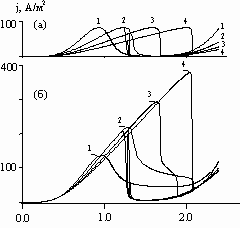
Рис. 4. Зависимость анодной (а) и катодной (б) плотности тока от приложенного напряжения при V = 36 В/час; ![]() =0,
=0, ![]() =0; и h, равных, см: 1 – 7; 2 – 5; 3 – 3; 4 – 1.
=0; и h, равных, см: 1 – 7; 2 – 5; 3 – 3; 4 – 1.
Из рисунка видно, что по мере сближения центров окружностей: 1) напряжение, соответствующее максимальной плотности тока, увеличивается (от линии 1 к линии 4); 2) напряжение, соответствующее минимальной плотности тока в пассивном состоянии анода (U1.5), практически не зависит от h; 3) на аноде максимальная плотность тока не зависит от h и совпадает с критической плотностью тока на анодной поляризационной кривой; на катоде максимум j растет (от линии 1 к линии 4).
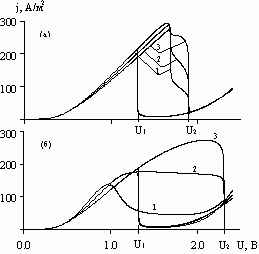
Рис. 5. Зависимость катодной плотности тока от напряжения при V=36 В/час; h, равных, см: (а) – 3; (б) – 7; и углах![]() , равных: 1 – 0; 2 –
, равных: 1 – 0; 2 –![]() /2; 3 –
/2; 3 –![]() .
.
На рис. 5 представлены зависимости плотности тока от напряжения в трех точках катодной границы при различных h. Из рисунка видно, что при увеличении h: 1) максимальная плотность тока в точке, наиболее близкой к аноду, падает (линия 1); 2) максимальная плотность тока в наиболее удаленной от анода точке (линия 3) практически не меняется; 3) напряжение U1 (переход анода в активное состояние при обратной развертке) от h практически не зависит; 4) напряжение U2 (переход анода в пассивное состояние при прямой развертке) - значительно увеличивается.
Общие коррозионные потери характеризуются суммарным анодным зарядом. В табл. 2 приведены значения заряда Q, стекающего с анодной поверхности цилиндра единичной длины при V=36 В/час за время пуска анодной защиты.
Таблица 2. Общий пусковой заряд Q, прошедший через анод при различных h.
| h, см. | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| Q, Кл | 4730 | 3860 | 3020 | 2810 | 2800 | 2860 | 2950 | 3100 |
Из таблицы видно, что значение заряда существенно зависит от расположения катода. Так, например, минимальный заряд (Qmin 2800 Кл) соответствует h4. Для сравнения отметим, что при скорости V=36 В/час заряд Qmin 9450 Кл при h2.7. Следовательно, оптимальное расположение катода при заданной скорости пуска V не является оптимальным при других значениях V.
Список литературы
Улиг Г.Г., Реви Р.У. Коррозия и борьба с ней. Л.: Химия, 1989. 455 с.
Атанасянц А.Г. Анодное поведение металлов. М.: Металлургия, 1989. 150 с.
Иванов В.Т., Глазов Н.П., Макаров В.А. // Итоги науки и техники. Коррозия и защита от коррозии. М.: ВИНИТИ, 1987. Т. 13. С. 117.
Агафонова Н.Н., Макаров В.А. // Защита металлов. 1989. Т. 25. С. 531.
Болотнов А.М., Иванов В.Т. // Электрохимия. 1996. Т. 32. С. 694.
Томашов Н.Д., Чернова Г.П. Пассивность и защита металлов от коррозии. М.: Наука, 1965. 207 с.
Дамаскин Б.Б., Петрий О.А. Электрохимия. М.: ВШ, 1987. 295 с.
Багоцкий В.С. Основы электрохимии. М.: Химия, 1988. 400 с.
Ильин В.П. Численные методы решения задач электрофизики. М.: Наука, 1985. 334 с.
Похожие работы
-
Электрический потенциал в биологических системах
Электрический заряд, подобно массе, является фундаментальным свойством веществ. Существует два типа зарядов, условно обозначенные как положительный и отрицательный.
-
Хронология открытий в физике электричества
Хронология открытий в физике электричества Ученый Открытие 1600 У. Гилберт Заложены основы электро и магнитостатики 1733 Ш. Дюфе Открытие двух видов электричества, установление притяжения разноименных зарядов и отталкивания одноименных
-
Огневое рафинирование меди
1.Способ огневого рафинирования расплава черной меди [Худяков В.И., Тихонов А.И., Деев В.И., Набойченко С.С. Металлургия меди, никеля и кобальта, часть 1. Металлургия меди, М.: Металлургия, 1977, 147-157, 185-187]. Способ включает окислительную продувку расплава черной меди в конверторе воздухом, загрузку в конвертор кокса в качестве топлива и кварцевого флюса для ошлакования окисленных примесей, раздельный слив из конвертора расплавов шлака и черновой меди.
-
Единое электродинамическое поле и его распространение в виде плоских волн
Рассматриваются структура и характеристики распространения векторного четырехкомпонентного единого электродинамического поля, реализующего своим существованием функционально связанные между собой составляющие его поля.
-
Потенциал поля
Работа сил электрического поля. Циркуляция вектора напряжённости электрического поля. Потенциал поля точечного заряда и системы зарядов. Связь между напряжённостью и потенциалом электрического поля. Эквипотенциальные поверхности.
-
Моделирование электростатического поля
Метод моделирования электростатического поля имеет широкое применение на практике. Пользуясь этим методом, изучают сложные электростатические поля (в электростатических линзах, в электронных трубках и т.п.).
-
Законы электролиза Фарадея
Два закона электролиза — это всего лишь небольшая часть вклада Майкла Фарадея в науку. Электролиз — это совокупность процессов, происходящих при пропускании электрического тока через электролит.
-
Случай бесконечной плотности объемного заряда и бесконечного суммарного заряда
Cлучаи c бесконечной плотностью заряда ρ физически абсолютно невозможны, но они "появляются" в задачах с точечными зарядами, заряженными нитями и плоскостями. При этом возникают некоторые сложности, а именно: - неограниченность поля и потенциала.
-
Расчет стационарного токораспределения в условиях смешанной кинетики
Рассматривается математическая модель стационарного электрического поля в электрохимической системе с учетом омического падения потенциала в электролите и концентрационных ограничений в приэлектродных диффузионных слоях.
-
Шаровая молния
Шаровая молния (ШМ) существует без подвода энергии извне, т.е. энергия необходима только в начальный момент. После образования (например, в результате электрического разряда) ШМ существует без поглощения дополнительной энергии.