Название: Азотная кислота
Вид работы: реферат
Рубрика: Биология и химия
Размер файла: 58.84 Kb
Скачать файл: referat.me-21638.docx
Краткое описание работы: Структура азотной кислоты. Дымящая азотная кислота. Строение кислоты с МВС.
Азотная кислота
МИНИСТЕРСТВО ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
ТВЕРСКОЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Факультет ______________________________
Кафедра________________________________
Курсовая работа
“Азотная кислота”
| Выполнил: | студент Х-Б-Г факультета | |
| Курс: | 1 | |
| Проверил: | Группа: | 16(2) |
| «_____»______________2001г. | Фамилия: | Лапшин Сергей |
Тверь - 2001г.
Содержание :
Содержание:................................................................................................................. 2
Структура азотной кислоты....................................................................................... 3
Безводная азотная кислота.......................................................................................... 3
Дымящая азотная кислота........................................................................................... 3
Строение кислоты с МВС........................................................................................... 3
Нитроний-ион.............................................................................................................. 4
Список литературы:.................................................................................................... 7
Структура азотной кислоты
Азотная кислота имеет tпл. =–41,6ºC, tкип =–82,6ºC. Её плотность составляет 1,552 г/см3 . С водой смешивается в любых соотношениях, образуя азеотроп (68,4% по массе HNO3 tкип =121,9ºC)
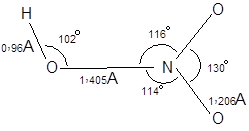 |
В газовой фазе молекула азотной имеет плоское строение. Вращение группы ОН относительно NO2 затруднено. В целом молекулу можно изобразить следующим образом:
Безводная азотная кислота
Азотная кислота, не содержащая воды, является безводной. В ней протекают следующие равновесные процессы:
![]()
Чистая азотная кислота самоионизированна:
![]() ,
,
причем мольная концентрация каждого вида частиц равна 0,51 моль/ л при -10ºC. В твердом состоянии молекула кислоты представляет собой гидроксид нитрония: ![]() .Интерес представляет собой взаимодействие азотной и серной кислот:
.Интерес представляет собой взаимодействие азотной и серной кислот:
![]() .
.
Отсюда видно, что азотная кислота амфотерна.
Дымящая азотная кислота
Азотную кислоту с концентрацией 97-99% часто называют дымящей. Дымящая азотная кислота при хранении разлагается:
![]()
![]()
Дымящая азотная кислота - сильный окислитель. Она способна поджечь скипидар и другие органические вещества.
Строение кислоты с МВС
Рассмотрим строение азотной кислоты с позиции метода валентных связей. Для этого посмотрим, какие орбитали принимают участие в образовании молекулы этой кислоты.
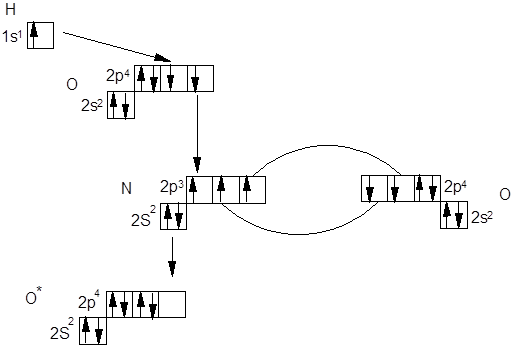
Таким образом азотную кислоту можно представить в виде:
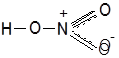 |
Однако современные методы исследования показали, что строение кислоты таково:
Отсюда видно, что молекула азотной кислоты имеет делокализованные связи.
Нитроний-ион
Этот ион ![]() непосредственно возникает не только при ионизации самой азотной кислоты, но и в реакциях нитрования или в растворах окислов азота в этой кислоте и в других сильных кислотах.
непосредственно возникает не только при ионизации самой азотной кислоты, но и в реакциях нитрования или в растворах окислов азота в этой кислоте и в других сильных кислотах.
Ранние физические измерения, выполненные известным ученым Ганчем, свидетельствовали об ионизации HNO3 в серной кислоте:
HNO3 +2H2 SO4 =H3 NO3 2+ +2HSO4 - .
Поздние исследования, проведенные Хьюзом, Ингольдом и другими учеными, показали, что предложения Ганча не вполне верно. Так, скорость нитрования бензола возрастает в 1000 раз при переходе от 80%-ных к 90%-ным растворам H2 SO4 . Подобные кинетические данные по нитрованию в растворах серной кислоты, нитрометана, и ледяной уксусной кислоты были объяснены тем, что атакующей частицей является - ион:
![]()
![]()
![]()
Важность ионизации первого типа подтверждается тем, что добавление ионизированных нитратов к реакционной смеси замедляет реакцию. Процесс нитрования можно представить в виде:
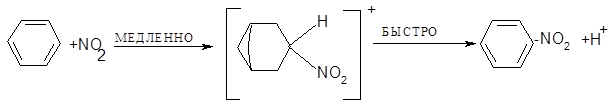
Окончательным подтверждением существования ионов нитрония явилось выделением солей нитрония. Соли содержат линейный катион:
Длина связи N-O составляет 110 пм. Выделение солей нитрония происходит следующим образом:
| (1) | |
| (2) | |
| (3) |
Реакции (1) и (2) представляют собой, в действительности, просто реакции обмена, поскольку N2
O5
в твердом состоянии и в растворе безводных кислот существуют в виде ионов ![]() и
и ![]() . Реакция (3) представляет собой реакцию ангидрида кислоты
. Реакция (3) представляет собой реакцию ангидрида кислоты ![]() c основанием
c основанием ![]() .
.
Соли нитрония - кристаллические вещества, термодинамически устойчивы, но химически очень активны. Они быстро гидролизуются влагой воздуха; кроме того, ![]() , например, бурно реагирует с органическими веществами, однако в растворе нитробензола его можно использовать для нитрования.
, например, бурно реагирует с органическими веществами, однако в растворе нитробензола его можно использовать для нитрования.
Соединения,содержащие нитроний-ион являются промежуточными соединениями при нитровании ароматических веществ.
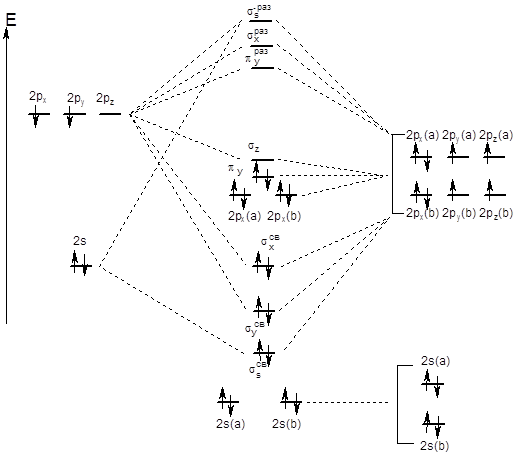
С метода молекулярных орбиталей нитроний-ион выглядит так:
писок литературы :
1. Ахметов Н.С. Неорганическая химия. М.:Высшая школа 1975.
2. Карапетьянц М.Х. Дракин С.И. Общая и неорганическая химия. М.: Химия1994
3. Коттон Ф. Уилкинсон Дж. Современная неорганическая химия. том.2. М.: Мир.1969.
4. Реми Г. Курс неорганической химии. том 1. М.: Мир.1972.
5. Общая химия./Под редакцией Соколовской Е.М. и Гузея Л.С. М.: Московский университет.1989.
6. Химический энциклопедический словарь/ редакцией И.Л.Кнунянца. М.: Московская энциклопедия. 1983.
Похожие работы
-
Влияние органических кислот цикла Кребса на образование триоз в листьях ячменя
Исследуется влияние органических кислот цикла Кребса на содержание триоз в листьях ячменя. Показа-но, что биосинтез триоз в зеленых и альбиносных листьях ячменя регулируется экзогенными интермедиатами цикла Кребса.
-
Абсорбция с4-олефинов отработанной серной кислотой процесса алкилирования
В процессе алкилирования изопарафинов олефинами в качестве катализатора используется серная кислота с концентрацией 88-98 %.
-
Моделирование процесса кислотного травления цинка в присутствии ингибиторов
При изготовлении клише в полиграфии используется размерное травление цинковых пластин, причем особенно важно исключить подтравливание под очко печатного элемента, обеспечив селективную защиту с помощью ингибирующих добавок.
-
АТФ и ее роль в клетке
В цитоплазме каждой клетки, а также в митохондриях, хлоро-пластах и ядрах содержится аденозинтрифосфорная кислота (АТФ). Она поставляет энергию для большинства реакций, происходящих в клетке.
-
Теория окислительно-восстановительных реакций
После открытия кислорода, французскому химику Лавуазье удалось выяснить, что горение есть реакция соединения с кислородом. В соответствии латинским наименованием кислорода "oxigenium" реакции соединения с кислородом были названы окислением.
-
Серная кислота
Технология серной кислоты. Сырье для серной кислоты и методы ее получения.
-
Экзамен по химии за 9 класс
Экзаменационные вопросы по химии.
-
Соляная кислота
Физические свойства. Способы получения.
-
Трехатомные спирты (алкантриолы, или глицерины)
Изометрия и основные свойства.
-
Серная кислота
Физические свойства. Химические свойства. Получение.