Название: Кинетика окисления сплавов в атмосфере воздуха при высокой температуре
Вид работы: лабораторная работа
Рубрика: Химия
Размер файла: 70.16 Kb
Скачать файл: referat.me-368851.docx
Краткое описание работы: Федеральное агентство по образованию Российской Федерации Кафедра физической химии Отчет по лабораторной работе на тему: "Кинетика окисления сплавов в атмосфере воздуха при высокой температуре"
Кинетика окисления сплавов в атмосфере воздуха при высокой температуре
Федеральное агентство по образованию Российской Федерации
Кафедра физической химии
Отчет по лабораторной работе на тему:
"Кинетика окисления сплавов в атмосфере воздуха при высокой температуре"
Цель работы:
Определить закон роста пленки на меди в изометрических условиях.
Принадлежности и приборы:
1. Образцы меди, латуни;
2. Тигельная печь с терморегулятором;
3. Секундомер;
4.Аналитические весы с нихромовой нитью и грузиком вместо левой чашки;
5. Разновесы;
6. Наждачная бумага;
7. Фильтровальная бумага;
8. Экспериментальная установка (рис. 1).
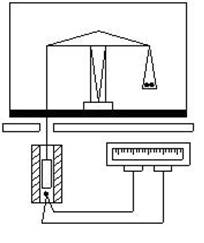
Рис. 1. Схема экспериментальной установки
Порядок выполнения работы:
1.1. Измерили размеры образцов и вычислили его поверхность S, см2 .
1.2. Зачистили используемые образцы наждачной бумагой, протерли фильтровальной бумагой и взвесили вместе с нихромовой нитью.
![]()
![]()
Образцы вынули из печи.
1.3. Нагрели печь без образца до температуры 800єС. Опустили образец в печь так, чтобы он свободно висел на нити и не задевал стенок печи. Закрыли течь крышкой, записали время начала опыта и взвесили образец.
1.4. В течение 30 минут взвешивали окисляющийся в атмосфере печи образец каждые две минуты, записывая каждый раз время от начала опыта и массу образца.
Обработка результатов:
2.1. Согласно пункту 1.1 провели измерение размеров образцов и рассчитали значение площади:
2.2. Результаты измерений пунктов 1.3-1.4 занесли в таблицу 1. По данной таблице построили графики для определения первоначальной массы образца (рис. 2).
Таблица 1. Результаты измерений и сделанных расчетов
| Название материала | Время τ | Масса m, г | 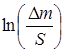 |
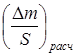 |
||
| Медь | 2 | 11,2546 | 0,0007 | 0,6931 | -7,3343 | |
| 4 | 11,2592 | 0,0000 | 1,3863 | -11,1844 | ||
| 6 | 11,2634 | 0,0006 | 1,7918 | -7,4708 | ||
| 8 | 11,2666 | 0,0010 | 2,0794 | -6,8940 | ||
| 10 | 11,2680 | 0,0012 | 2,3026 | -6,7185 | ||
| 12 | 11,2714 | 0,0017 | 2,4849 | -6,3886 | ||
| 14 | 11,2741 | 0,0021 | 2,6391 | -6,1872 | ||
| 16 | 11,2761 | 0,0023 | 2,7726 | -6,0605 | ||
| 18 | 11,2772 | 0,0025 | 2,8904 | -5,9970 | ||
| 20 | 11,2788 | 0,0027 | 2,9957 | -5,9114 | ||
| 22 | 11,2819 | 0,0031 | 3,0910 | -5,7639 | ||
| 24 | 11,2830 | 0,0033 | 3,1781 | -5,7164 | ||
| 26 | 11,2846 | 0,0035 | 3,2581 | -5,6510 | ||
| 28 | 11,2857 | 0,0037 | 3,3322 | -5,6085 | ||
| 30 | 11,2864 | 0,0038 | 3,4012 | -5,5823 | ||
| Латунь | 2 | 1,5366 | 0,0040 | 0,6931 | -5,5262 | |
| 4 | 1,5379 | 0,0037 | 1,3863 | -5,5905 | ||
| 6 | 1,5395 | 0,0034 | 1,7918 | -5,6756 | ||
| 8 | 1,5403 | 0,0033 | 2,0794 | -5,7211 | ||
| 10 | 1,5406 | 0,0032 | 2,3026 | -5,7387 | ||
| 12 | 1,5411 | 0,0031 | 2,4849 | -5,7687 | ||
| 14 | 1,5415 | 0,0030 | 2,6391 | -5,7934 | ||
| 16 | 1,5419 | 0,0030 | 2,7726 | -5,8187 | ||
| 18 | 1,5418 | 0,0030 | 2,8904 | -5,8123 | ||
| 20 | 1,5426 | 0,0028 | 2,9957 | -5,8646 | ||
| 22 | 1,5428 | 0,0028 | 3,0910 | -5,8781 | ||
| 24 | 1,5432 | 0,0027 | 3,1781 | -5,9057 | ||
| 26 | 1,5430 | 0,0028 | 3,2581 | -5,8918 | ||
| 28 | 1,5436 | 0,0026 | 3,3322 | -5,9341 | ||
| 30 | 1,5440 | 0,0026 | 3,4012 | -5,9633 |
На основании полученных данных строим графики:
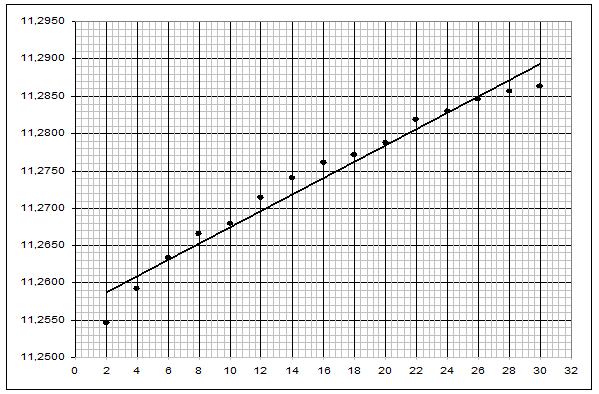
Рисунок 2. График зависимости ![]() для медного образца
для медного образца
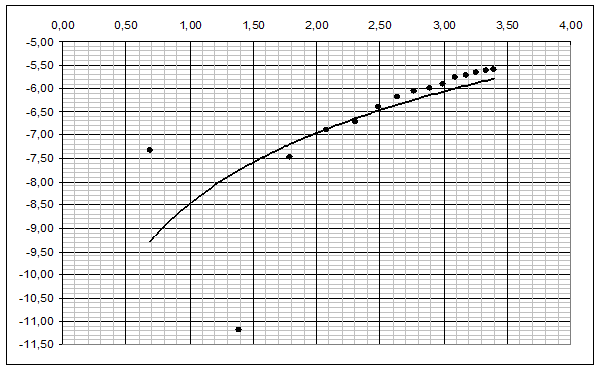
Рисунок 3. График зависимости 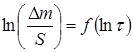 для медного образца
для медного образца
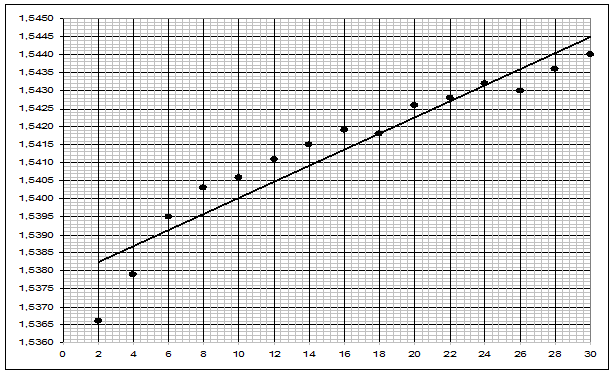
Рисунок 4. График зависимости ![]() для латунного образца
для латунного образца
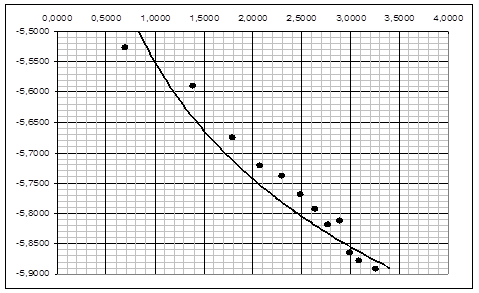
Рисунок 5. График зависимости 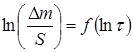 для латунного образца
для латунного образца
2.3. Построили график lg Δm/S=f(lgτ) (рис. 3), определили коэффициенты логарифмического уравнения и выразили через них закон роста оксидных пленок:
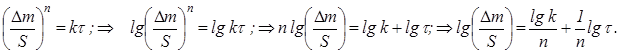
Пусть ![]() Закон роста оксидных пленок в логарифмических координатах выражается уравнением прямой линии
Закон роста оксидных пленок в логарифмических координатах выражается уравнением прямой линии ![]() ,тогда:
,тогда:
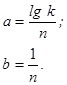
Похожие работы
-
Основы физической химии
Расчет теплового эффекта реакции в изобарном и изохорном процессах в стандартных условиях и при заданной температуре. Определение направления протекания процесса в изолированных и закрытых системах. Изменение температуры в самопроизвольных реакциях.
-
Термодинамические характеристики (H,S,G) и возможность самопроизвольного протекания процесса
Уравнение химической реакции с использованием электронно-ионного метода. Определение потенциалов окислителя и восстановителя, направления протекания процесса, термодинамических характеристик H,S,G. Электронная формула элементов по 2 и 4 квантовым числам.
-
Кинетика полимеризации изопрена под влиянием каталитических систем на основе карбоксилатных солей лантаноидов
Изучение основных реакций, обусловливающих формирование молекулярной цепи полиизопрена, и их количественная оценка. Участие молекул мономера и непредельных фрагментов полиизопрена в определении концентрации активных центров в процессе полимеризации.
-
Ректификационная установка непрерывного действия для разделения 4,1 т/ч бинарной смеси ацетон - этанол
РОССИЙСКИЙ ХИМИКО-ТЕХНОЛОГИЧЕСКИЙ УНИВЕРСИТЕТ ИМ. Д. И. МЕНДЕЛЕЕВА КАФЕДРА ПРОЦЕССОВ И АППАРАТОВ ХИМИЧЕСКОЙ ТЕХНОЛОГИИ ПОЯСНИТЕЛЬНАЯ ЗАПИСКА К КУРСОВОМУ ПРОЕКТУ ПО ПРАЦЕССАМ И АППАРАТАМ НА ТЕМУ :
-
Крахмал (Доклад)
Министерство Образования Российской Федерации Доклад по Химии на тему Крахмал Выполнил: Ученик 10 кл. Б Нечин Евгений Красноярск, 1998 Крахмал Крахмал состоит из 2 полисахаридов - амилозы и амилопектина, образованных остатками глюкозы. Экспериментально доказано, что химическая формула крахмала (C6H10O5)n.
-
Физико-химия конкретных промышленных каталитческих процессов
Окислительный аммонолиз пропилена и окислительное хлорирование этилена. Основные особенности процессов окисления в псевдоожиженном слое катализатора. "Воздушный" и "кислородный" процессы. Рециркуляционные технологии. Кинетика и механизм реакций.
-
Об особенностях пострадиационного окисления захваченных радикалов в полиэтилене высокой и низкой плотности
Зависимость относительной концентрации захваченных аллильных радикалов от времени перенесения из вакуума на воздух при комнатной температуре. Сравнение кинетики накопления стабильных радикалов в образцах с начальными концентрациями аллильных радикалов.
-
Химия радиоматериалов
Федеральное агентство связи Сибирский Государственный Университет Телекоммуникаций и Информатики Межрегиональный центр переподготовки специалистов
-
Контрольная работа по Пищевой химии
Министерство образования и науки Российской Федерации Федеральное агентство по образованию Тольяттинский филиал Московского государственного университета пищевых производств
-
Отчет по лабораторной работе Термодинамика
2. Теоретическая часть. Раздел химии, изучающий скорость и механизм протекания физико-химических процессов, называется химической кинетикой. Кинетика позволяет выяснить реальные механизмы протекания процессов. В химической кинетике различают гомогенные и гетерогенные процессы.