Название: Альдегиды и кетоны: общие сведения и способы получения
Вид работы: контрольная работа
Рубрика: Химия
Размер файла: 125.27 Kb
Скачать файл: referat.me-368173.docx
Краткое описание работы: Карбонилсодержащие или карбонильные соединения - альдегиды и кетоны. Подвижные жидкости. Температуры кипения. Растворимость низших кетонов и альдегидов в воде за счет образования водородных связей. Методы получения. Окисление углеводородов и спиртов.
Альдегиды и кетоны: общие сведения и способы получения
Введение
Альдегиды и кетоны объединяют общим названием карбонилсодержащие или карбонильные соединения. В кетонах к карбонильной группе присоединены два углеводородных остатка, а в альдегидах один из них водород. В формальдегиде к карбонильной группе присоединены два атома водорода.
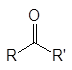
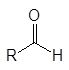
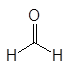
кетоны альдегиды формальдегид
При назывании альдегидная группа может рассматриваться и как заместитель:
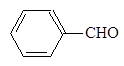
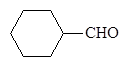
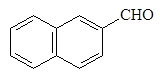
бензолкарб - циклогексан - 2-Нафталин-
альдегид карбальдегид карбальдегид
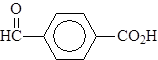
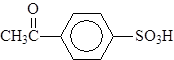
4-метаноилбензойная кислота 4-этаноилбензолсульфокислота
(п-формилбензойная кислота) (п-ацетилбензолсульфокислота)
За исключением газообразного формальдегида, низшие альдегиды и кетоны представляют собой подвижные жидкости. Температуры кипения альдегидов и кетонов ниже температур кипения спиртов с тем же числом атомов углерода, так как карбонильные соединения сами по себе водородных связей не образуют. Низшие альдегиды и кетоны растворимы в воде, видимо, за счет образования водородных связей:
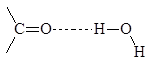
Способы получения.
Многие методы получения альдегидов и кетонов сходны, но существует и ряд особых способов, пригодных для синтеза только альдегидов или только кетонов.
Окисление углеводородов.
Простейший альдегид – формальдегид – можно получать окислением метана кислородом воздуха в присутствии медно-цинкового катализатора:
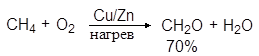 (1)
(1)
Окислением толуола может быть получен бензальдегид. Наиболее перспективно окисление кислородом воздуха в присутствии катализатора (например, V2O5):
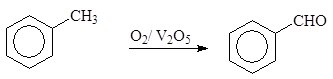 (2)
(2)
Ацетофенон производится в промышленности каталитическим окислением этилбензола кислородом воздуха:
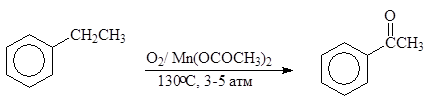 (3)
(3)
В качестве окислителя иногда используют серную кислоту. Так, обработка адамантана концентрированной серной кислотой при 75 оС в течение 5 ч с выходом 50-60% дает адамантанон:
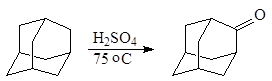 (4)
(4)
адамантан фдамантанон
Окисление этилена в присутствии хлоридов палладия (II) и меди (II) приводит к образованию ацетальдегида (Вакер-процесс):
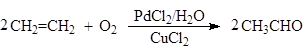 (5)
(5)
При окислении этилена кислородом в присутствии триоксида молибдена и фосфорной кислоты сначала образуется окись этилена, но она немедленно изомеризуется в уксусный альдегид. Для уменьшения времени контакта, и предотвращения дальнейшего окисления ацетальдегида одновременно пропускают водяной пар.
![]() (6)
(6)
Окисление спиртов
Окисление спиртов обсуждалось в разделе 12.2.5. Окислением метанола получают формальдегид
![]() (7)
(7)
Важный растворитель метилэтилкетон получают в промышленности окислением 2-бутанола.
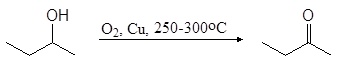 (8)
(8)
В лабораторных же условиях в качестве окислителя используется бихромат калия или натрия в кислой среде. Окислителем в этом случае является хромовая кислота. Например, реакция
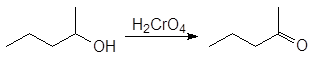 (9)
(9)
проходит по следующему механизму:
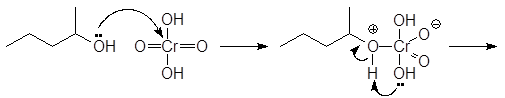 (М 1)
(М 1)
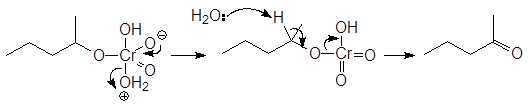
Альдегиды могут быть получены из первичных спиртов путем их окисления пиридинийхлорхроматом (ПХХ):
![]()
Упр.1. Напишите реакцию получения гептаналя из 1-гептанола.
Упр.2. Напишите реакции, лежащие в основе промышленных методов получения (а) формальдегида, (б) ацетальдегида, (в) бензальдегида, (г) ацетона, (д) ацетофенона?
Упр.3. Предложите схему получения формальдегида из СО и Н2.
Гидроформилирование алкенов (Оксосинтез)
При температуре от 30 до 250 оС и давлении 100-400 атм в присутствии дикобальтоктакарбонила алкены присоединяют водород и монооксид углерода с образованием альдегидов. Обычно получается смесь изомеров:
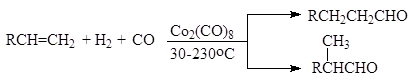 (10)
(10)
Пиролиз солей карбоновых кислот.
При нагревании бариевых или кальциевых солей карбоновых кислот образуются кетоны. Именно так впервые был получен ацетон:
![]() (11)
(11)
Из дикарбоновых кислот > С6 и выше получают циклические кетоны:
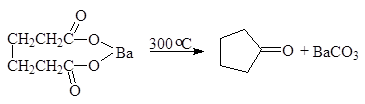 (12)
(12)
Упр.4. Напишите реакции получения (а) ацетона, (б) диэтилкетона и
(в) циклопентанона пиролизом бариевых солей соответствующих кислот.
Реакция Гаттермана-Коха.
Арены формилируют смесью СО и HCl в присутствии хлоридов алюминия и меди (I):
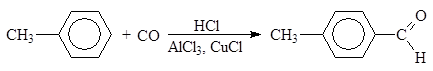 (13)
(13)
п-толуиловый альдегид
Эта реакция представляет собой вариант ацилирования, так как смесь CO и HCl можно представить себе как неустойчивый хлорангидрид муравьиной кислоты:
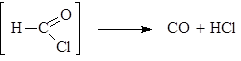
Роль CuCl состоит в первоначальном образовании комплекса с СО, что повышает его концентрацию в реакционной смеси.
Фенолы и простые эфиры, а также нитробензол и все соединения с электро-ноакцепторными заместителями в реакцию Гаттермана-Коха не вступают.
Упр.5. Напишите схемы получения по реакции Фриделя-Крафтса:
(а) пропиофенона; (б) бутирофенона; (в) бензофенона.
Упр.6. Напишите схемы получения ацетофенона: (а) окислением углеводо-рода, (б) окислением спирта, (в) гидролизом дигалогенуглеводорода, (г) ацилиро-ванием бензола.
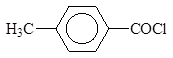
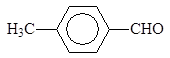
Восстановление производных карбоновых кислот
Альдегиды можно получать восстановлением производных карбоновых кислот. Хлорангидриды кислот могут быть превращены в альдегиды восстановлением водородом в присутствии палладия, нанесенного на сульфат бария. Катализатор дезактивируют добавками хинолина с серой или тиомочевиной.
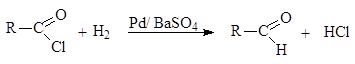
В современных методах в качестве восстановителей используют различные комплексные гидриды металлов. Одним из лучших восстановителей служит трис (трет-бутокси) гидроалюминат лития, образующийся при взаимодействии алюмогидрида лития с трет-бутиловым спиртом.
Эфиры и нитрилы карбоновых кислот восстанавливаются в альдегиды с помощью диизобутилалюминийгидрида.
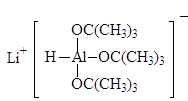
LiAlH(t-BuО) 3
 |
Трис(трет-бутокси) гидроалюминат лития Диизобутилалюминийгидрид
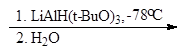 |
 (14)
(14)
Эфиры и нитрилы карбоновых кислот восстанавливаются в альдегиды с помощью диизобутилалюминийгидрида.
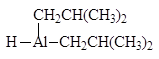
(DIBAL-H)
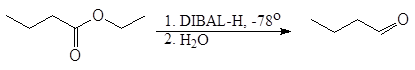 (15)
(15)
Литийдиалкилкупратный метод получения кетонов
При действии литийдиалкилкупрата на хлорангидриды карбоновых кислот в эфире при охлаждении образуются кетоны:
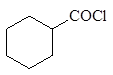 |
![]()
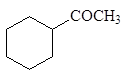 (16)
(16)
Упр.7. Напишите реакции, приводящие к следующим превращениям:
(а) бензол ® бромбензол ® фенилмагнийбромид ® бензиловый спирт ® бензальдегид; (б) толуол ® бензойная кислота ® бензоилхлорид ® бензальдегид;
(в) этилбромид ® 1-бутин ® 2-бутанон; (г) 2-бутин ® 2-бутанон; (д) 1-фенилэтанол ® ацетофенон. (е) бензоилхлорид ® ацетофенон; (ж) бензойная кислота ® ацетофенон; (з) бензилбромид ® С6Н5СН2СN ® 1-фенил-2-бутанон;
(и) С6Н5СН2СN ® 2-фенилэтаналь: (з) метилкапронат ® гексаналью
В результате взаимодействия альдегидов и кетонов с углеродными нуклеофила-ми образуются новые связи С¾С. Такими нуклеофилами служат реактивы Гриньяра, литийорганические соединения, ацетилениды и циановодородная кислота.
![]()
![]()
![]()
![]()
А. Присоединение реактивов Гриньяра.
Особая ценность реактивов Гриньяра заключается в их способности создавать новые связи С¾С. Разница в электроотрицательности между углеродом и магнием (2,5 - 1,2 = 1,3), обусловливает полярность связи между этими атомами и наличие частичного отрицательного заряда на атоме углерода и частичного положительно-го заряда на атоме магния. В реакциях реактивы Гриньяра ведут себя как карбанионы. Карбанионы являются хорошими нуклеофилами и легко присоединяются к карбонильной группе. Магнийорганические соединения вступают в реакции нуклеофильного присоединения к альдегидам и кетонам с образованием алкоксидов, гидролизующихся в спирты:
Присоединение к формальдегиду приводит к образованию первичных спиртов.
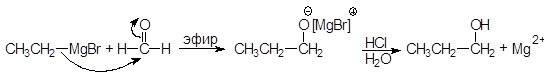
(17)
Другие альдегиды дают вторичные спирты:
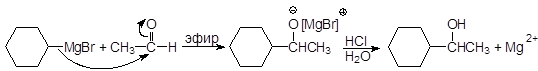 (18)
(18)
1-Циклогексилэтанол
Из кетонов получают третичные спирты:
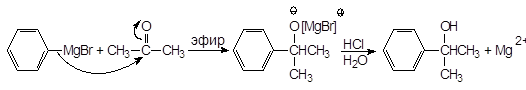
2-Фенил-2-пропанол
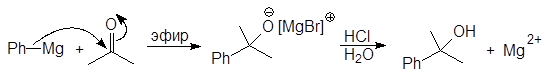 (19)
(19)
Б. Присоединение литийорганических соединений.
Литийорганические соединения более реакционноспособны, чем магнийлрганичес-кие и обеспечивают больший выход целевого продукта. Онако с ними можно работать только в атмосфере инертного газа. Ниже приводится пример использования литийорганического соединения для получения стерически затрудненного третичного спирта.
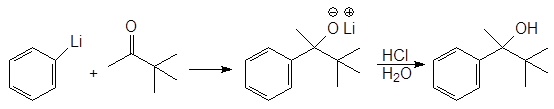 (20)
(20)
Фениллитий 3,3-Диметил-2-бутанон 3,3-Диметил-2-феил-2-бутанол
В. Присоединение ацетиленидов металлов
Этинид-анион также является нуклеофилом. Образующиеся при этом спирты содержат две функциональные группы, каждая из которых может быть далее модифицирована.
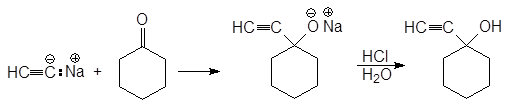 (21)
(21)
1-этинилциклогексанол
Гидратация полученного алкинола приводит к образованию a-гидроксикетона, а гидроборирование-окисление -b-гидроксиальдегида.
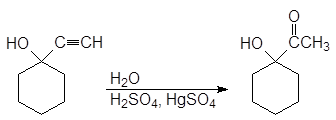 (22)
(22)
1-ацетилциклогексанол
(a-гидроксикетон)
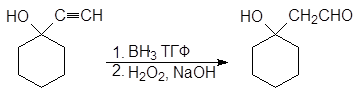 (23)
(23)
2-(1-гидроксициклогексил) этаналь
(b-гидроксикетон)
Похожие работы
-
ОВР с участием органических веществ
ОВР с участием органических веществ В ОВР органических веществ с неорганическими органические вещества чаще всего являются восстановителями. Так, при сгорании органического вещества в избытке кислорода всегда образуется углекислый газ и вода. Сложнее протекают реакции при использовании менее активных окислителей.
-
Ненасыщенные альдегиды и кетоны
Ненасыщенные альдегиды и кетоны Ненасыщенные альдегиды и кетоны, в зависимости от взаимного расположения двойной и карбонильной групп в молекуле, могут быть поделены на три группы: с сопряженными (CH=CH
-
Альдегиды и кетоны
Введение Это единения, содержащие карбонильную группу = С = О . У альдегидов карбонил связан радикалом и водородом. Общая формула альдегидов: R – C = O У кетонов карбонил связан с двумя радикалами. Общая формула кетонов:
-
Насыщенные альдегиды и кетоны
Альдегиды и кетоны относятся к карбонильным соединениям (содержат группу >С=О) Они имеют общую формулу: для альдегидов R1=H. Изомерия кетонов связана со строением радикалов и с положением карбонильной группы в углеродной цепи. Кетоны называют по номенклатуре IUPAC называют аналогично альдегидам, но прибавляют окончание -он.
-
Способы получения спиртов
Основные способы получения спиртов уже рассматривались при обсуждении реакционной способности галогенопроизводных, элементоорганических соединений и алкенов. Особенно следует выделить получение метанола и этанола.
-
Химические свойства альдегидов и кетонов. Реакции окисления и восстановления
Окисление и восстановление альдегидов и кетонов. Радикальный механизм через образование гидроперекисей. Реакция серебряного зеркала. Устойчивость кетонов к окислению. Окисление по Баеру-Виллегеру. Восстановление боргидридом натрия и изопропиловым спиртом.
-
Химические свойства альдегидов и кетонов. Присоединение кислородных нуклеофилов
Альдегиды и кетоны – их химические свойства. Двойная связь. Электронодефицитный и электроноизбыточный центр. Молекулы карбонильных соединений, имеющие несколько рекреационных центров. Образование ацеталей посредством присоединения спиртов. Нуклеофилы.
-
Синтезы на основе малонового эфира, кислоты Мельдрума и ацетоуксусного эфира
Строение и схема получения малонового эфира. Синтез ацетоуксусного эфира из уксусной кислоты, его использование для образования различных кетонов. Таутомерные формы и производные барбитуровой кислоты. Восстановление a,b-Непредельных альдегидов и кетонов.
-
Органические соединения
Реферат 61314.0.1287405047.doc по химии Оглавление. Предельные углеводороды. (Алканы.). Нонан. 2 Непредельные углеводороды (Алкены. Алкины). Нонен-1. 4
-
Реакции альдегидов и кетонов: присоединение углеродных нуклеофилов
Реакции альдегидов и кетонов. Нуклеофильное присоединение и углеродных нуклеофилов. Присоединение реактивов Гриньяра. Присоединение литийорганических соединений. Присоединение ацетиленидов металлов. Циангидринный синтез. Реакция Реформатского.